
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод перманганотометричного титрування
|
|
|
|
Ступень окиснення. Процеси окиснення та відновлення. Метод електронного балансу.
Сту́пінь оки́снення — умовний електростатичний заряд, який приписують атому в молекулі, припускаючи, що електронні пари, які здійснюють зв'язок, повністю зміщені в бік більш електронегативних атомів (тобто припускаючи, що всі зв'язки даного атома мають 100% йонний характер).
Ступінь окиснення, на відміну від валентності, може мати позитивне, негативне, нульове і дробове значення. Це значення зі знаком плюс чи мінус перед арабською цифрою зазначається над символом елемента: Наприклад:
+1 −2
Н2O,
Окиснення-відновлення, окислювально-відновні реакції, хімічні реакції, що супроводжуються зміною окислювальних чисел атомів. Спочатку окисненням називалися лише реакції з'єднання з киснем, відновленням ≈ відібрання кисню. З введенням в хімію електронних уявлень виявилося можливим широко узагальнити поняття Про окиснення та відновлення і поширити його на реакції, в яких кисень не бере участь. Згідно електронної теорії, окисленням називається віддача електронів атомом, молекулою або іоном: Zn √ 2 = Zn2 +.
- Відновленням називається приєднання електронів атомом, молекулою або іоном: Cl2 + 2 = 2Cl √.
- Окислювачами називається нейтральний атом, молекула або іон, що приймають електрони (у другому прикладі молекула хлору Cl2), відновниками ≈ нейтральний атом, молекула або іон, що віддають електрони (у першому прикладі ≈ атом Zn). Окислення і відновлення ≈ взаємопов'язані процеси, які завжди протікають одночасно. Коли одна речовина окислюється, то інше відновлюється, і навпаки. Так, приведені вище приватні реакції окислення і відновлення складають єдиний процес: Zn + Cl2 = ZnCl2.
Тут Zn окислюється до Zn2 +, а Cl2 відновлюється до 2Cl √.
У хімії окислювально-відновні реакції належать до числа найбільш поширених. Наприклад, на них, як правило, грунтується отримання простих речовин (металів і неметалів)
CuO + H2 = Cu + H2O,
2КВг + Cl2 = Br2 + 2KCl.
|
|
|
Метод електронного балансу - один з методів зрівнювання окислювально-відновних реакцій (ОВР). Полягає в тому щоб на підставі ступенів окислення розставити коефіцієнти в ОВР.Для правильного зрівнювання слід дотримуватися певної послідовності дій:
1. Знайти окисник і відновник.
2. Скласти для них схеми (напівреакції) переходів електронів, що відповідають даним окислювально-відновлювального процесу.
3. Зрівняти число відданих і прийнятих електронів в напівреакцій.
4. Підсумувати порізно ліві і праві частини напівреакцій.
5. Розставити коефіцієнти в рівнянні окисно відновної реакції.
Перманганат-іон у сильнокислих розчинах окиснює багато речовин, відновлюючись при цьому до марганця (ІІ):
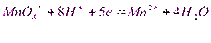
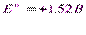
У зв’язку з дуже високим редоокс-потенціалом цього переходу, перманганат можно застосовувати для титрування майже усіх речовин, здатних окиснюватись.
З рівняння

видно, що окиснювальний потенціал сильно залежить від рН розчину. Тому кількість кислоти при титруванні береться значно більшою, ніж це потрібно за стехіометричним рівняння (розчин повинен бути приблизно 1н за кислотою). В іншому випадку можливий перебіг побічних процесів, наприклад:

Для підкислення розчину застосовуеться звичайно сірчана кмслота, оскільки HCl відновлюється перманганатом, а азотна кислота сама здатна виступати як окисник, що, зрозуміло, у кількісному аналізі неприпустимо.
При титруванні перманганатом індикатор звичайно не застосовують, оскільки його власне забарвлення досить інтенсивне. Воно з’вляється в точці еквівалентності, точніше, зразу не після неї, для цього необхідна усього одна надлишкова крапля титранта.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 397; Нарушение авторских прав?; Мы поможем в написании вашей работы!