
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розділ 2. Дисперсні системи
|
|
|
|
ОСОБЛИВІ ВИПАДКИ КОАГ УЛЯЦІЇ
При коагуляції сумішами електролітів спостерігаються три ефекти: адитивність дії, антагонізм і синергізм електролітів.
Адитивність полягає в тому, що кожний електроліт діє незалежно
При антагонізмі електролітів вони ніби протидіють один одному, і для коагуляції золю їх потрібно більше, ніж за правилом адитивності (крива 2).
Синергізмом називають посилення коагулюючої дії одного електроліту при додаванні другого (крива 3). В цьому випадку для коагуляції їх треба додати менше, ніж за правилом адитивності.
Адитивнісгь спостерігається у іонів однакового заряду і близьких за властивостями (К\ N3; СІ і Вг)
Тема 2.1. Методи одержання та очистки дисперсних систем.
Методи одержання дисперсних систем. Диспергацiйнi i конденсацiйнi методи одержання дисперсних систем. Адсорбцiйне зниження мiцностi тiл. Ефект Ребiндера, його практичне значення та областi застосування. Приклади одержання дисперсних систем методами фiзичної та хiмiчної конденсацiї. Пептизацiя. Методи очищення лiозолiв – дiалiз, електродiалiз, ультрафiльтра-цiя. Застосування методiв одержання дисперсних систем в хiмiчних та бiо-хiмiчних технологiях.
Визначення розмiру частинок дисперсних систем. Седиментацiя i дисперсiй-ний аналiз. Закон Стокса. Кiлькiсний опис седиментацiї частинок дисперсних систем. Принципи седиментацiйного аналiзу. Седиментацiйний аналiз моно-, бi- та полiдисперсних систем. Аналiз седиментацiйної кривої. Побудова кривої розподiлу частинок за радiусами. Седиментацiя в штучному гравiтацiйному полi.
Тема 2.2. Властивості дисперсних систем.
Молекулярно-кiнетичнi властивостi дисперсних систем. Броунiвський рух, його природа. Середнiй зсув. Дифузiя. Закон Фiка. Рiвняння Ейнштейна для коефiцiєнта дифузiї. Спiввiдношення мiж середнiм зсувом i коефiцiєнтом дифузiї (рiвняння Ейнштейна-Смолуховського). Особливостi осмотичного тиску дисперсних систем. Використання осмотичних властивостей для визначення концентрацiї i розмiру частинок дисперсних систем. Седиментацiйно-дифузiйна рiвновага - вивiд i аналiз рiвняння.
|
|
|
Оптичнi властивостi дисперсних систем. Свiтлопоглинання i свiтлорозсiю-вання. Ефект Тиндаля. Рiвняння Релея i його аналiз. Нефелометрiя як метод визначення концентрацiї i дисперсностi гетерогенних систем. Визначення форми частинок оптичними методами. Оптична густина дисперсних систем - рiвняння Бугера-Бера. Вплив дисперсностi на забарвлення гетерогенних високодисперсних систем. Визначення дисперсностi бiлих золiв i молекуляр-них мас ВМС за рiвнянням Гелера. Ультрамiкроскопiя та її можливостi. Конденсор темного поля. Електронна мiкроскопiя.
Термічним аналізом називають фізико-хімічний метод аналізу дослідження рівноваги в багатокомпонентних системах, заснований на вимірюванні зміни температури в залежності від часу.Цей аналіз дозволяє робити висновки про зміни в системі при її охолодженні або нагріванні.
В основі термічного аналізу лежить спостереження за швидкістю охолодження або за швидкістю нагрівання чистих речовин і розплавів різних складів, а також побудова кривих охолодження в координатах температура - час. В залежності від природи системи, її складу, криві охолодження мають різний вигляд. Для побудови діаграми стану переносять усі точки зламів і температурних зупинок з кривих охолодження на координатну сітку температура - склад, а потім з'єднують отримані точки.
Розглянемо утворення кривих охолодження для найпростішої двокомпонентної металевої системи, яка складається з компонентів А та В, що не розчинні в твердому стані (малюнок 3.3). Криві охолодження та відповідні їм склади зразків позначені римськими цифрами I, II, III, IV, V, VI. Усі зразки однакові по масі, але різні по концентрації компонентів, їх початковий стан позначено точками 1.
|
|
|

При охолодженні складу І (тобто чистого компоненту А) починаючи з точки 1 температура монотонно зменшується до температури Т0А (ділянка 1 -
3 на кривій охолодження І). Тут в точці 3 починається ізотермічна кристалізація компоненту А і деякий час (до точки 4) температура лишається сталою - витрати теплоти компенсуються теплотою кристалізації. Така зупинка (горизонтальна ділянка 3 - 4 на кривій охолодження І) триває до повної кристалізації. Подальше охолодження твердого компоненту А відповідає похилій ділянці
4 - 5 на кривій охолодження. Крива охолодження для складу VI (чистий компонент В) ідентична розглянутій кривій для складу І з тією різницею, що горизонтальна ділянка 5 - 6 розташована при температурі Т0В.
Охолодження складу ІІ, який вміщує обидва компоненти - А(80%) та В (20%)до точки 2 відбувається практично рівномірно. В точці 2, яка розташована на лінії ліквідус, сплав стає насиченим по відношенню до компонента А, починається кристалізація А і процес охолодження уповільнюється. Це пояснюється тим, що з одного боку втрати теплоти частково компенсуються теплотою кристалізації, з іншого боку в результату кристалізації вміст А в розплаві, а отже і температура кристалізації, зменшуються. З цієї причини на кривій охолодження ІІ в точці 2 спостерігається злам - різка зміна нахилу.
Після досягнення температури кристалізації евтектики ТЕ (точка 3) ізотермічна кристалізація евтектичного складу призводить до появи горизонтальної ділянки 3 - 4 на кривій охолодження ІІ (стала температура утримується за рахунок теплоти кристалізації). Після цього відбувається майже рівномірне охолодження твердого сплаву (ділянка 4 - 5). Для складів ІІІ та V криві охолодження аналогічні і відрізняється лише положенням точки зламу 2.
Склад IV - евтектичний, він кристалізується при сталій температурі ТЕ. На кривій охолодження для цього складу є горизонтальна ділянка 3 - 4, але відсутня точка зламу 2.
Одержані в результаті експерименту криві охолодження (мал..3.3а) використовують для побудови діаграми стану (мал..3.3в) таким чином: на діаграмі стану проводять вертикальні лінії, які відповідають кожному складу, що вивчався (пунктирні лінії на мал. 3.3в). З відповідної кривої охолодження на лінії складу переносять точки зламу 2 та точки кристалізації евтектики 3 - 4. З'єднуючи проекції точок 2, одержують лінію ліквідус Т0А - ТЕ - Т0В. Через проекції точок 3 (або 4) проводять лінію солідус СБ.
|
|
|
Системи з сполуками, що плавляться конгруентно
та інконгруентно
Якщо компоненти А и В можуть утворити тверду хімічну сполуку АВ, що плавиться без розкладу, тобто конгруентно, то на діаграмі стану, приведеної на мал. (3.4), крива ліквідусу утворить максимум у точці С, коли склад кристалічної фази збігається зі складом рідкої фази.

Діаграма стану двокомпонентної системи, на якій компоненти А и В можуть утворити сполуку АВ, що плавиться інконгруентно, тобто з розкладанням, приведена на мал. 3.6.

|
Малюнок 3.6. Діаграма стану системи з хімічною сполукою, що плавиться інконгруентно
Діаграми стану трикомпонентних систем
Графічне представлення складу потрійних систем
У трикомпонентній системі змінними величинами є тиск, температура і дві концентрації. Звичайно дослідження трикомпонентних конденсованих систем ведуть при постійному тиску. Залежність властивостей системи від трьох змінних можна зобразити у виді просторової діаграми, що являє собою тригранну прямокутну призму. Основою призми служить рівносторонній трикутник, що характеризує склад потрійної системи, а висотою - температура. Вершини рівностороннього трикутника відповідають чистим речовинам А, В и С (мал. 3.13). Усі точки, розташовані усередині трикутника, виражають склади трикомпонентних систем. Процентний вміст кожного з компонентів у системі тим більше, ніж ближче розташована дана точка до відповідної вершини.
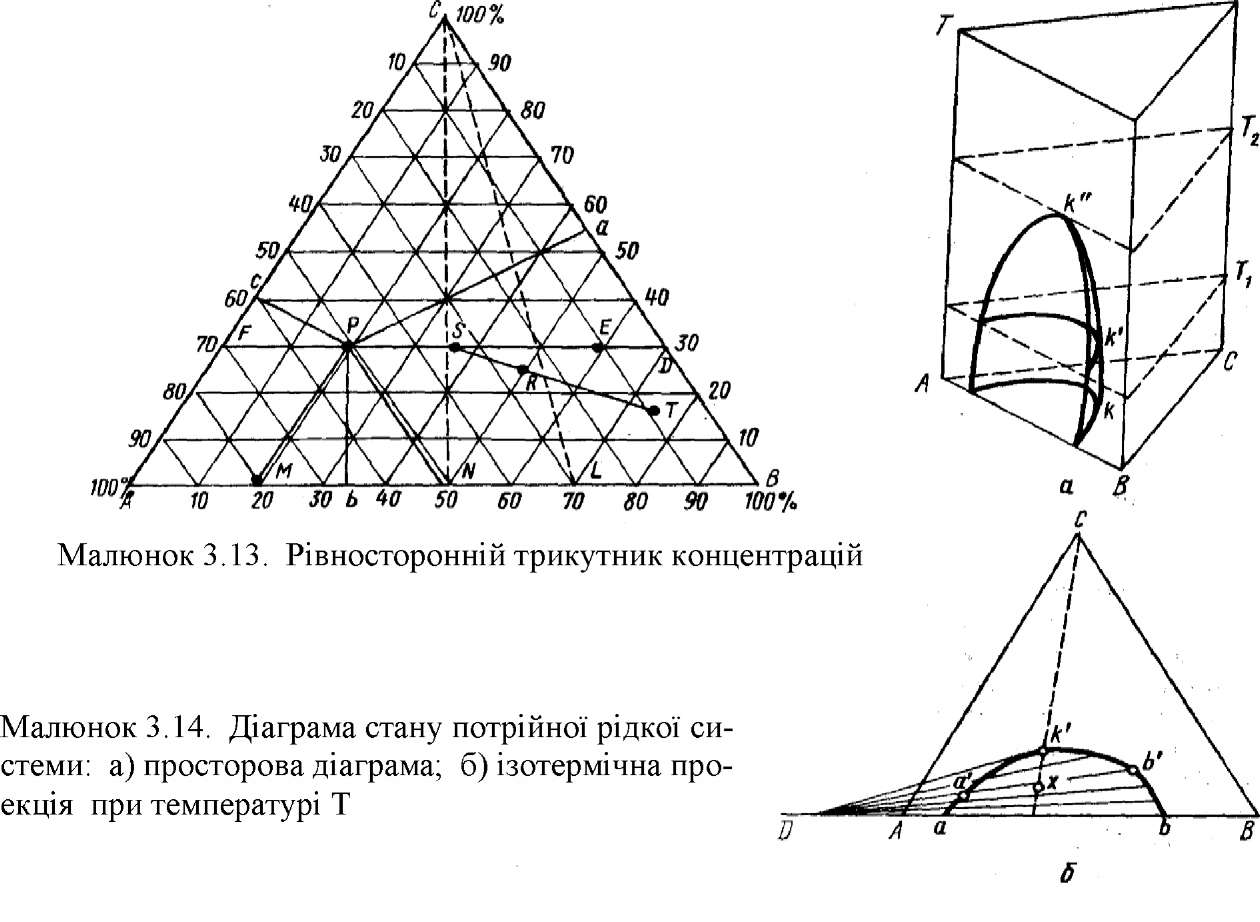
|
Для визначення складу за допомогою трикутника концентрацій з даної точки на кожну зі сторін трикутника опускають перпендикуляри (трикутник Гіббса). Цей спосіб запропонований Гіббсом. Він заснований на тому, що сума довжин перпендикулярів, опущених з будь-якої точки усередині рівносторон- нього трикутника на його сторони, є величина стала, вона дорівнює висоті трикутника, яку приймають за 100%. Так, наприклад, точка Р трикутника Гиб- бса відповідає складу А 50%, В 20%, С 30%.
|
|
|
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1763; Нарушение авторских прав?; Мы поможем в написании вашей работы!