
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хід уроку. Приклади таких сполук
|
|
|
|
P P
S S S
2 8 6
Приклади таких сполук.
Написати електронну формулу сульфуру, визначити
Школи
Приклади розв'язування вправ:
можливі валентності сульфуру в сполуках. Привести
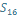 ; +16; 16e; 3 період max
; +16; 16e; 3 період max 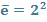
 6A група
6A група
)))
d
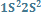 2
2 
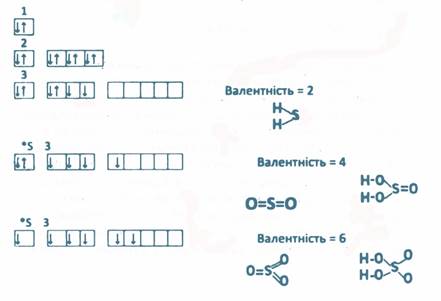
3. Використовуючи елементи 3 періоду, приведіть приклади речовин з різними типами хімічного зв'язків.
1) Металевий зв'язок - катіони Ме у вузлах кристалічної гратки сполучаються з допомогою усуспільнених делокалізованих електронів. В третьому періоді метали матимуть теж Ме зв'язок: Na, Mg, Al.
2) Ковалентний зв'язок - зв'язок за рахунок спільних електронних пар. Якщо електронна пара симетрично розташована між атомами, то такий зв'язок називають ковалентним неполярним: Cl2
Якщо електронна пара зміщена до більш електронегативного атома, то такий зв'язок називають ковалентним полярним:SiF4, Al2S3,AlCl3,MgS.
3) Іонний зв'язок - результат електростатичної взаємодії протилежно заряджених іонів, його можна розглядати як крайній^ випадок ковалентного полярного. Тому в періоді іонний зв'язок утворюватиметься між крайніми елементами в періоді: NаСl
4. Використовуючи елементи 3 періоду приведіть приклади різних класів неорганічних сполук. Складіть графічні формули цих сполук.
1) Основні оксиди - утворені Ме і оксигеном:
Na2O; MgO, АІ20з
Кислотні оскиди - утворені неМе і оскигеном:
SiO2, Р205, SО з, S02, Сl2O7, Сl2O5, Сі2O3, СІ2O
2) Гідроксиди:
Основні включають в себе Ме і гідроксильну групу: NaОН, Мg(ОH)2, Аl(ОН)з
Кислотні гідроксиди включають в себе неМе і гідроксильну групу: Н2SiОз
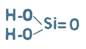
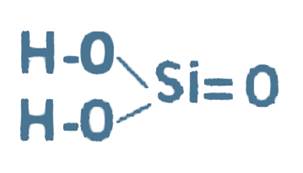
2. Намалюйте схеми будови атомі С і Sі. Поясніть чим схожі і чим відрізняються властивості цих елементів.
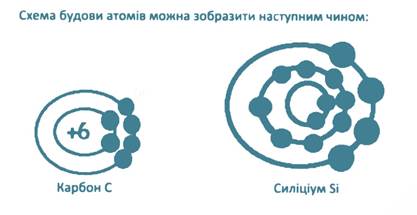
Будову електронних хмар атомів цих елементів можна записати
|
|
|
наступним чином:
1S22S22P2 ; Si14 1s22S22P63S23S2
В зовнішньому шарі електронної хмари у атомів елементів С і Sі міститься по 4 електрони, які розташовуються на однакових підрівнях 2S22Р2; 3S2ЗР2. Tому максимальна негативна і позитивна ступінь окиснення цих елементів в хімічних сполуках дорівнює чотирьом. За рахунок збільшення радіуса атомів, а відповідно і віддалення валентного шару електронів у силіцію з'являються металічні властивості і слабшають неметалічні.
Відмінності в поведінці цих елементів будуть проявлятись в тому, що для карбону існують сполуки, де він формально двохвалентний, наприклад оксид карбону(ІІ). Такі сполуки для силіцію нехарактерні. В той же час у силіцію є вакантні, незайняті р- і d- хмари, які можуть приймати участь в утворенні хімічних зв'язків.

Завдання для самостійного розв'язування:
1. Скільки валентних електронів мають елементи: AS, Se Ca, Zn?
2. Визначити які оксиди можливі для елемента Вr35,
пояснити відповідь, використовуючи записи електронної формули елементу. Записати їх.
3. Запишіть можливі гідроксиди для елемента Ge32. Який характер їх властивостей? Відповідь пояснити.
4. Використовуючи елементи К, Ca, Zn, Сl, Br, Se, та іон ОН запишіть максимальну кількість сполук і зрізними типами зв'язку.
5. напишіть графічні формули сполук: HCl, HNO3, Н2СОз, Са(НСОз)2, CaS04, Zn(N03)2, ZnOHCl.
6. Серед речовин SiCI, HCl, NaH, Na2S, MgO, CO,NF3, CaF2 визначіть сполуки з іонним зв'язком.
7. Визначте ступені окиснення галогенів у таких сполуках: СІ2O, I2O5, IF7, СВr4, КВrОз, НСlO4, АІВr3.
Будову електронних хмар атомів цих елеме  нгі&можна записати
нгі&можна записати
наступним чином:
1S22S22P2 ; Si14 1s22S22P63S23S2
В зовнішньому шарі електронної хмари у атомів елементів С і Бі міститься по 4 електрони, яі і розташовуються на однакових підрівнях 2Б22Р2; 352ЗР2. "Іому максимальна негативна і позитивна ступінь окиснення цих елементів в хімічних сполуках дорівнює чотирьом. За рахунок збільшення радіуса атомів, а відповідно і віддалення валентного шару електронів у силіцію з'являються металічні властивості і слабшають неметалічні. иМ Відмінності в поведінці цих елементів будуть проявлятись в тому, що для карбону існують сполуки, де він формально двоф&лентний, наприклад оксид карбону(ІІ). Такі сполуки для силіцію нехарактерні. В той же час у силіцію є вакантні, незайняті р- і сі- хмари, які можуть приймати участь в утворенні хімічних зв'язків.
|
|
|
3) Солі (Щоб написати формули солей, необхідно виходити з формули кислоти)
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 782; Нарушение авторских прав?; Мы поможем в написании вашей работы!