
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантово-механічне тлумачення будови молекул і їх поведінки СТ. 45 1-9
|
|
|
|
Теорія подібності та її використання у фізико-технологічних процесах
Тео́рія поді́бності — це вчення про умови подібності фізичних явищ. Теорія подібності спирається на вчення про розмірність фізичних величин і служить науковою основою моделювання, як методу пізнання і дослідження різних об'єктів, в якій основну роль відіграє метод аналогій, тобто схожості об'єктів за деякими ознаками. Фізичні явища, процеси або системи подібні, якщо у подібні моменти часу в подібних точках простору значення змінних величин, що характеризують стан однієї системи, пропорційні відповідним величинам іншої системи. Коефіцієнт пропорційності для кожної з величин називається коефіцієнтом подібності.
З розвитком досліджень складних фізичних та фізико-хімічних процесів, що включають механічні, теплові, хімічні явища, розвиваються і методи теорії подібності для цих процесів, наприклад, встановлюються умови подібності процесів тертя та зношування, кінетики фізико-хімічних перетворень, моделювання атмосферних явищ тощо.
Теорія подібності є основою для планування експериментів та обробки їх результатів.
1) Молекулярна фізика - розділ курсу загальної фізики, в якому вивчаються макроскопічні властивості речовини, обумовлені його молекулярною будовою, характером руху молекул і силами, що діють між ними.
В основі молекулярної фізики лежить встановлене на досвіді твердження: в якому б стані не знаходилася речовина (твердому, рідкому, газоподібному), складові його молекули знаходяться в безперервному хаотичному (непередбаченому) русі, яке називають тепловим. Хоча рух будь-якої молекули речовини підкоряється законам механіки, описати рух кожної молекули з великої сукупності (наприклад, в 1м3 повітря при нормальних умовах перебуває 2,7 • 1025 молекул) практично неможливо. У зв'язку з цим в молекулярній фізиці розроблено два взаємно доповнюють один одного теоретичних методу - статистичний і термодинамічний.
|
|
|
Вуглецева одиниця, уніфікована атомна одиниця маси, складова маси атома ізотопу вуглецю 12 C.
В. е. була запропонована в 1959 Міжнародним союзом теоретичної і прикладної хімії (IUPAC), прийнята в 1960 Міжнародним союзом теоретичної і прикладної фізики (IUPAP) і затверджена на конгресі IUPAC в 1961. В. е. рівна (1,66043 ± 0,00031)×10 -24 р.
2 ) Моль речовини. Число Авогадро. Характерний розмір молекул.
Моль — одиниця кількості речовини в системі СІ. Позначається моль, Mol. Інша назва — грам-молекула.
Кількість речовини, що містить число Авогадро (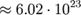 ) структурних формульних одиниць. Формульні одиниці — реальні частки, такі як атоми, молекули, іони, радикали.
) структурних формульних одиниць. Формульні одиниці — реальні частки, такі як атоми, молекули, іони, радикали.
За формальним означенням моль — це кількість речовини, виражена в грамах, що чисельно дорівнює її молекулярній масі і відзначається тим, що одному молю будь-якої речовини відповідає однакова кількість молекул. А саме, 1 моль містить стільки молекул (атомів, йонів, інших структурних елементів речовини), скільки атомів у 0,012 кг вуглецю 12С, тобто дорівнює сталій Авоґадро.
Позначення «Моль» введене у 1893 році Вільгельмом Оствальдом і походить від слова «молекула».
3) рівняння Клапейрона - Менделєєва - залежність між параметрами ідеального газу, що визначають його стан: pV = BT, де коеф. пропорційності В залежить від маси газу М та його молек. маси. Встановлений франц. ученим Б. П. Е. Клапейроном в 1834. У 1874 Д. І. Менделєєв вивів ур-ня стану для одного моля ідеального газу; pV = RT, де R - універсальна газова стала.
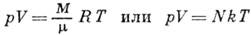
де N - число частинок газу.
4) Термодинам́ічний процéс – це сукупність послідовних станів, через які проходить термодинамічна система при взамодії її з навколишнім середовищем. При цьому усі чи частина параметрів зазнають змін. Ці зміни параметрів повинні відбуватися таким чином, щоби система знаходилась у рівновазі.
|
|
|
Зако́н Бо́йля — Маріо́тта — закон ідеальних газів, згідно з яким добуток тиску на об'єм незмінної маси такого газу при сталій температурі є величина стала:
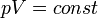
.
У певних межах справедливий для розріджених реальних газів, тобто для природних і нафтових вуглеводневих газів за нормальних (чи стандартних) умов. Тоді його записують так: p0 V0 = pV, де індекс нуль означає ці умови.
5) Зако́н Гей-Люсса́ка — Закон Гей-Люссака – назва двох законів, що описують властивості газів.
1) Закон теплового розширення газів: при сталому тискові залежність об’єму Vt даної маси газу від температури описується формулою:
Vt/T = const
або
Vt=V0(1+ αt),
де V0 об'єм газу при даному тискові і при температурі 273,15 К; t – температура (емпірична) за шкалою Цельсія; Т – термодинамічна температура; α – коефіцієнт об’ємного розширення газу (для інертних газів, водню і кисню а дорівнює коефіцієнту об’ємного розширення ідеального газу α = 1/(273.15 К)).
2) Закон об’ємних відношень, за яким при постійних температурі і тиску об'єми газів, які вступають у реакцію, відносяться між собою і до об’ємів газоподібних продуктів реакції, як невеликі прості числа. Наприклад, при взаємодії одного об’єму водню з одним об’ємом хлору утворюється два об’єми хлористого водню.
6) Зако́н Ша́рля — назва закону, що описує властивості газів. Описує ізохорний процес в ідеальному газі.
Закон теплового розширення газів: при сталому об'ємі залежність тиску Р даної маси газу від температури описується формулою:
 ,
,
де Т — термодинамічна температура; Р — тиск газу.
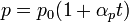 , чи
, чи  ,
,
де 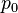 — тиск газу при температурі
— тиск газу при температурі  ,
,
 — термічний коефіцієнт тиску, що характуризує відносне збільшення тиску газу при нагріванні його на один градус.
— термічний коефіцієнт тиску, що характуризує відносне збільшення тиску газу при нагріванні його на один градус.
7 ) Парціа́льний тиск — тиск окремо взятого компонента газової суміші.
Парціа́льний тиск - внесок газу певного роду в загальний тиск суміші газів.
Згідно із законом Дальтона у випадку ідеальних газів парціальні тиски окремих компонент суміші газів сумуються
|
|
|
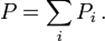
Парціальний тиск кожної із компонент, пропорційний долі цієї компоненти в суміші газів.
Pi = xiP,
де
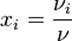 ,
,
ν i - кількість молів i-го газу в суміші, ν - загальна кількість молів газу.
Парціальні тиски кожної з компонент можуть бути розраховані, використовуючи рівняння стану, таким чином приведена формула задає рівняння стану суміші.
Закон Дальтона – загальний тиск P суміші ідеальних газів дорівнює сумі парціальних тисків Pi компонентів у суміші:
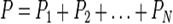
Джон Дальтон встановив цей закон емпірично в 1801. Закон справедливий для газів, близьких до ідеальних. В реальних газах, для яких суттєва взаємодія між молекулами суміші, можуть існувати суттєві відхилення від такого простого правила.
Випаровування над водною поверхнею визначають за допомогою емпіричних формул, одержаних при використанні з акону Дальтона.
8) Молекулярно-кінетична теорія газового тиску
Кінетична теорія або молекулярно-кінетична теорія - фізична теорія, що пояснює термодинамічні явища, виходячи з атомістських уявлень. Теорія постулює, що тепло є наслідком хаотчиного руху надзвичайно великої кількості мікроскопічних частинок (атомів та молекул). В сучасній фізиці молекулярно-кінетична теорія розглядається як складова частина статистичної механіки.
Молекулярно-кінетична теорія виходить із того, що речовина, зокрема газ складається з великої кількості мікроскопічних частинок (молекул), які рухаються хаотично. Частинки стикаються між собою та зі стінками посудини, створюючи на ці стінки тиск. Усі зіткнення вважаються пружними, тобто проходять без втрати енергії. Середня кінетична енергія руху частинок залежить від температури.
Середня кінетична енергія руху молекули
 ,
,
де m - маса частинки, v - її швидкість, kB - стала Больцмана, T - температура.
Середня швидкість частинок у газі дорівнює

де R - газова стала, M - молярна маса.
Тиск газу на стінки посудини визначається з того міркування, що при пружньому відбитті частинки від стінки, зміна її імпульсу дорівнює 2mvx, де vx - перпендикулярна до стінки складова швидкості. Підрахувавши переданий за час Δt імпульс, і прирівнявши його до імпульсу сили для тиску отримуємо
|
|
|
 ,
,
де n - кількість частинок в одиничному об'ємі.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 341; Нарушение авторских прав?; Мы поможем в написании вашей работы!