
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв'язування задач
|
|
|
|
Задача 1. Для лікування раку шкіри застосовується колхамінова мазь, яка складається з води, емульгатора, спирту, колхаміну, тимолу й синтоміцину. Скільки ступенів вільності має ця система?
Розв'язування. Число незалежних компонентів у цій системі К = 6 і співпадає з кількістю речовин, бо вони між собою хімічно не реагують. Кількість фаз Ф = 1, оскільки ця мазь є однорідною системою. Тоді за правилом фаз Ґіббса число ступенів вільності конденсованої системи становить: С=К – Ф+1=6 – 1+1 = 6, такими параметрами буде температура і ще 5 незалежних концентрацій будь-якої із 6 речовин. А концентрацію шостої речовини знаходять за різницею між 100 % і сумою п'яти інших.
Задача 2. Використовуючи діаграму стану Sb – Pb (рис. 2.1.), визначити кількість стибію, яка викристалізувалася, при охолоджуванні до 430°С 3 кг рідкого сплаву із вмістом 40 % свинцю.

Рис. 2.1. Діаграма стану Sb – Pb
Розв'язування. Якщо сплав, що містить 40 % свинцю, охолодити до 430 °С, то стан його на діаграмі зображатиметься точкою G. У міру кристалізації сурми процентний вміст свинцю в рідкому сплаві зростає до 60 %. Позначимо масу сурми що викристалізувалася х, а масу рідкого сплаву – у. Згідно правила важеля (або правила відрізків) кількість фази (х), яка викристалізувалася, так відноситься до кількості взятого рідкого розплаву (у), як відрізок, прилеглий до кривої кристалізації GD, до відрізка FD, що характеризує склад рідкої фази при охолодженні до заданої температури, тобто
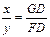 .
.
З даного рівняння визначаємо 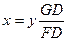 .
.
Із рис.2.1 визначаємо, що FD = 60, а GD = 60 – 20 = 40.
Тоді  .
.
Відповідь: При охолоджуванні 3 кг рідкого сплаву із вмістом 40 % свинцю виділиться у вигляді кристалів 1 кг стибію.
Задача 3. Евтектичний сплав стибію і свинцю містить 13 % стибію (див. рис. 2.1). Який з металів і в якій кількості знаходитиметься в сплаві у вигляді кристалів, вкраплених в евтектику, якщо 10 кг рідкого сплаву, що містить 10 % стибію, охолодити до повного його затвердіння.
|
|
|
Розв'язування. Склад сплаву: Sb – 10%; Pb – 90%. Знаходимо кількість (кг) кожного із металів в 10 кг рідкого сплаву: свинцю 10∙0,9 = 9 кг, стибію 10∙0,1 = 1 кг. Оскільки процентний вміст стибію в сплаві менший ніж вміст його в евтектиці, то увесь стибій витрачається на утворення евтектики.
Визначимо масу евтектичного сплаву (х). Згідно умови в 100 кг евтектичного сплаву міститься 13 кг стибію. Складемо пропорцію і з одержаного рівняння визначаємо х:
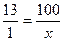 ,
,
 7,7 кг.
7,7 кг.
Решта частина сплаву є кристалами свинцю, вкрапленими в евтектику. Маса їх дорівнює 10 – 7,7 = 2,3 кг.
Відповідь:7,7 кг і 2,3 кг.
Задача 4. Яку максимальну кількість йоду можна добути з 10 дм3 мінеральної води, в 1 дм3 сірковуглецю (екстрагентом служить 0,1 дм3 сірковуглецю), якщо при 25 0С коефіцієнт розподілу йоду між сірковуглецем та водою дорівнює 588. Молекулярна маса йоду в обох розчинниках однакова (в 1 дм3 Н2О міститься 3∙10-3 моль І2).
Розв'язування. Розраховуємо масу І2, яка може бути одержана при однократній екстракції. Знайдемо спочатку вміст йоду у вихідному розчині:
m0 = 254∙3∙10-3 ∙ 10 = 7,62 г.
Тоді: 
Маса добутого йоду: 7,62 – 1,11 = 6,51 г.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 480; Нарушение авторских прав?; Мы поможем в написании вашей работы!