
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретична частина. Тема: Електрична провідність розчинів електролітів
|
|
|
|
Тема: Електрична провідність розчинів електролітів. Кондуктометричне титрування. Визначення ізотонічного коефіцієнту розчину електроліту.
ЗАНЯТТЯ №5
Актуальність: Водні розчини електролітів широко використовують у фармації для приготування лікарських препаратів. Знання закономірностей поведінки електролітів у водних розчинах необхідне для правильного їх використання як основи фармацевтичних препаратів. Методи фізико-хімічного дослідження, що ґрунтуються на вимірюванні електричної провідності розчинів (кондуктометрія) широко використовують в фармації, медико-біологічних дослідженнях.
Навчальні цілі:
Знати:
- основи теорії Арреніуса, закон розбавлення Оствальда;
- основи протолітичної теорії Бренстеда-Лоурі;
- сучасні теорії дисоціації слабких електролітів Льюїса, Ізмайлова;
- визначення понять: “термодинамічна константа дисоціації”, “активність та коефіцієнт активності”, “йонна сила розчину”;
- основні положення електростатичної теорії сильних електролітів Дебая-Гюккеля;
- закон Кольрауша, поняття про йонну провідність розчинів;
- визначення понять: рухливість йонів та число переносу йонів;
- основи методу кондуктометрії та його використання.
Вміти:
- записати та проаналізувати математичний вираз закону розбавлення Оствальда;
- дати визначення поняттям кислота та основа, виходячи з позицій теорій Бренстеда-Лоурі та Льюїса;
- обчислити рН розчинів слабких і сильних кислот та основ;
- провести кріоскопічні вимірювання та обчислити ізотонічний коефіцієнт даного електроліту в розчині;
- визначати кондуктометричну сталу комірки приладу, використовуючи стандартні розчини KCl;
- визначати питому провідність досліджуваних розчинів, користуючись кондуктометром;
|
|
|
- побудувати криву кондуктометричного титрування і визначити точки еквівалентності.
Електроліти – це речовини, які в розчиненому (чи розплавленому стані) проводять електричний струм. Розчини електролітів володіють електропровідністю, яка обумовлена тим, що молекули електролітів у воді і деяких інших розчинниках дисоціюють на йони – частинки, які несуть електричні заряди.
Електроліти можна поділити на 2 типи: сильні і слабкі.
При дисоціації слабких електролітів встановлюється йонна рівновага, що характеризується константою рівноваги. Для бінарного електроліту цю рівновагу схематично можна виразити рівнянням:
АВ = А+ + В–.
За законом дії мас константу рівноваги К визначають за співвідношенням:
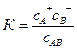 ,
,
де сА+ і сВ– – відповідно концентрації йонів А+ і В–; сАВ – концентрація недисоційованих молекул АВ. 
 Якщо один моль електроліту міститься у V літрах розчину, а ступінь дисоціації його дорівнює α, то концентрації йонів А+ і В– відповідно дорівнюватимуть
Якщо один моль електроліту міститься у V літрах розчину, а ступінь дисоціації його дорівнює α, то концентрації йонів А+ і В– відповідно дорівнюватимуть
сА+ = сВ– = α/ V.
Частина молекул, що не розпадаються на йони, становить 1 – α, тоді:
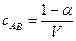 .
.
Підставляючи визначені значення сА+, сВ-, сАВ в рівняння 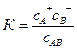 одержимо:
одержимо:
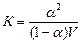 .
.
Замінюючи V на 1/с, знайдемо:
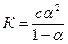 .
.
Це рівняння дістало назву закону розбавлення Оствальда. Воно зв'язує між собою константу дисоціації розчиненого електроліту, ступінь його дисоціації та концентрацію.
Константа дисоціації при сталій температурі в одному й тому самому розчиннику має стале значення лише для слабких електролітів у сильно розбавлених розчинах. Ступінь електролітичної дисоціації речовини, розчиненої в даному розчиннику, залежить (при сталій температурі) від природи і концентрації речовини. Ці кількісні характеристики розчинів слабких електролітів можна визначати різними способами, зокрема методом електропровідності.
|
|
|
Для слабких кислот і основ значення α дуже мале і ним у знаменнику рівняння 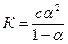 можна знехтувати. Тоді рівняння матиме вигляд:
можна знехтувати. Тоді рівняння матиме вигляд:
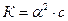 звідки
звідки 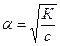 .
.
Силу основ і кислот зручніше характеризувати константою дисоціації, оскільки ступінь дисоціації електроліту змінюється залежно від концентрації розчину.
Електроліти, ступінь дисоціації яких перевищує 30 %, умовно відносять до сильних електролітів. Для кількісного описування таких розчинів застосувати рівняння класичної теорії електролітичної дисоціації, не припустивши великих похибок, неможливо. Тому для розчинів сильних електролітів загальну концентрацію замінюють ефективною (тобто такою, що проявляє себе в дії), яка інакше називається активністю електроліту, або активністю його йонів і позначається буквою а.
Активність бінарного електроліту записують рівнянням:
а = а+а–.
Отже, активність а виражає ефективну концентрацію дисоційованої частини електроліту в розчині, що відображає сумарну дію двох факторів – неповної дисоціації молекул (якщо вона має місце) і взаємне притягання різнойменних йонів.
Ефективна концентрація в f разів більша від загальної концентрації, тобто:
a = f c.
Активність катіонів і аніонів у розчині можна записати:
а+ = f + с+; а– = f – с–.
де f + і f – – відповідно коефіцієнти активності катіонів і аніонів; с+ і с– відповідно концентрації катіонів і аніонів.
Практично можна визначити лише середній коефіцієнт активності всього електроліту, тому і активності катіонів і аніонів електроліту також будуть середніми активностями:
а+ = f±c+; а– = f ±с- ; а± = f±c.
Середній коефіцієнт активності для сильно розбавлених розчинів залежить від загальної концентрації йонів усіх розчинених електролітів і від їхніх валентностей. Тому для характеристики залежності активності електроліту від концентрації всіх йонів, що знаходяться в розчині, Льюїс і Рендель ввели поняття про йонну силу І.
І = 1/2 (с1z12 + с2z22 + с3z32 +... сіzі2),
де сі– концентрації відповідних йонів; zі– їх валентності.
Коефіцієнт активності даного електроліту в розбавлених розчинах сильних електролітів має стале значення, якщо ці розчини мають однакові йонні сили.
Згідно з теорією сильних електролітів, залежність між середнім коефіцієнтом активності електроліту і йонною силою для розбавлених водних розчинів, йонна сила не перевищує 0,01 (при 298 К), виражається формулою:
|
|
|
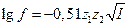 ,
,
де z1 і z2 – заряди йонів; І – йонна сила розчину. Це рівняння називають рівнянням Дебая – Гюккеля.
Розчини електролітів замерзають при нижчій і киплять при вищій температурі, ніж розчини неелектролітів, однакові за молярною концентрацією, що є відхиленням від законів Рауля. Розчини електролітів мають вищий осмотичний тиск, ніж це випливає з закону Вант-Гоффа для неелектролітів. Тому в рівняння, що описують властивості розчинів неелектролітів, Вант-Гофф ввів поправочний множник і, який назвав ізотонічним коефіцієнтом. Це дало можливість застосовувати такі рівняння до розчинів електролітів:
π = iC мRT;
Δ Т зам = іk кр С m;
Δ Т кип = іk еб С m;
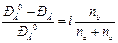 .
.
Отже, ізотонічний коефіцієнт показує, у скільки разів зниження тиску пари і температури замерзання та підвищення температури кипіння і осмотичного тиску, визначені експериментально для розчинів електролітів, більші, ніж обчислені за мольними концентраціями останніх.
Буферними системами називають розчини, які здатні зберігати стале значення рН середовища при розбавленні або при додаванні до них невеликих кількостей сильної кислоти чи лугу, а також при їх концентруванні. Найпоширенішими є водні кислотно-основні буферні розчини, які містять слабку кислоту і поєднану з нею основу. До біологічних буферних систем організму належать чотири типи буферних розчинів: гідрогенкарбонатний, фосфатний, гемоглобіновий та білковий. Вони характеризуються різною буферною ємністю та неоднаковим вмістом у фізіологічних рідинах.
рН для даного складу буферного розчину є величина постійна, однак змінюючи співвідношення концентрації кислоти і солі, можна одержувати в кожному випадку інше значення рН буферної системи, яке може коливатися в деяких певних межах.
Для розрахунку рН кислотного буферного розчину використовують формулу: 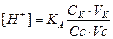 звідки за рівнянням Гендерсона – Гассельбаха:
звідки за рівнянням Гендерсона – Гассельбаха:
|
|
|
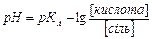 або
або  ,
,
а для основних буферних розчинів:
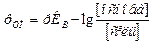 .
.
Здатність буферних розчинів протидіяти зміні рН називають буферною дією. Буферна ємність (В) – це розрахункова величина, яка визначається числом грам-еквівалентів сильної кислоти або сильної основи, яку треба додати до 1 дм3 буферного розчину, щоб змінити значення рН на одиницю.
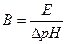 .
.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1127; Нарушение авторских прав?; Мы поможем в написании вашей работы!