
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретичні відомості. Електрохімічна система, в якій за рахунок хімічних реакцій здійснюється електрична робота, називається гальванічним (електрохімічним) елементом
|
|
|
|
Електрохімічна система, в якій за рахунок хімічних реакцій здійснюється електрична робота, називається гальванічним (електрохімічним) елементом. Загальну схему гальванічного елемента можна представити таким чином:
М | метал1| розчин1 || розчин 2| метал 2 | М.
Межі поділу фаз в схемі позначаються вертикальними лініями, М – металічний дріт (звичайно в схемі елемента позначення дроту випускають).
Якщо на обох кінцях елемента міститься один провідник (М), елемент називають правильно розімкнутим. Різниця потенціалів на кінцях правильно розімкнутого елемента є його електрорушійною силою (ЕРС). ЕРС гальванічного елемента дорівнює сумі стрибків потенціалів на межах поділу фаз:
E = φ1 + φ2 + φд + φк,
де j1 і j2 – електродні потенціали, jд – дифузійний потенціал, jк – контактний потенціал.
Механізм виникнення електродного потенціалу пов’язаний із виникненням подвійного електричного шару, якщо занурити металеву пластинку в розчин власної солі, то можливі два протилежні процеси:
а) перехід йонів металу із пластинки в розчин під дією диполів води:
 .
.
б) осадження йонів Men+ на пластинці:
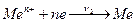 .
.
У розведених розчинах швидкість переходу йонів з активного металу в розчин більша, ніж швидкість зворотного процесу, яка можлива при високих концентраціях Men+.
При цьому зменшується кількість позитивно заряджених йонів на металі, які перейдуть в розчин, а на металі буде негативний заряд, і чим більша буде різниця v 1 – v 2, тим негативнішим буде заряд електроду.
Рівноважний стан різниці потенціалів на межі поділу фаз метал–розчин називають електродним потенціалом. Він обмежує процес подальшого переміщення йонів з металу або на метал, у зв'язку з чим кожному металу і певній концентрації його солі відповідає той чи інший потенціал. Величина електродного потенціалу залежить від природи металу та активності його йонів у розчині і її розраховують за формулою:
|
|
|

де R – універсальна газова стала; Т – температура, за якої відбувається реакція; n – кількість електронів, що втрачає атом металу; F – стала Фарадея; а(Меn+) – активність йонів металу в розчині, j0 – стандартний електродний потенціал.
Вище приведене рівняння – називають рівнянням Нернста (1890 р.). Якщо в нього підставити значення сталих величин (R = 8,314 Дж/моль∙К; F = 9,65∙104 Кл/моль), то для досить розбавлених розчинів за температури 298 К матимемо:

Тепер визначимо фізичну суть величини (j0) у рівнянні електродного потенціалу Нернста. Якщо за стандартних умов активність йонів металу в розчині дорівнює 1 кмоль/м3, то lg а (Меn+) = lg1 = 0, тоді j = j0. Отже, j0 – це електродний потенціал, який виникає при зануренні металевої пластинки в розчин, в якому активність йонів металу дорівнює 1 кмоль/м3. Ця величина одержала назву стандартного (або нормального) електродного потенціалу.
Стрибок потенціалу на межі поділу метал–розчин, як і різницю потенціалів між двома точками, які перебувають у різних фазах, експериментально виміряти неможливо. Дослідним шляхом вимірюють лише ЕРС кола, що складається з досліджуваного та стандартного електро 
 да, потенціал якого умовно приймають рівним нулю. Таким електродом за міжнародною угодою є стандартний водневий електрод.
да, потенціал якого умовно приймають рівним нулю. Таким електродом за міжнародною угодою є стандартний водневий електрод.
Стандартний водневий електрод – це платинова пластинка, яка занурена в розчин сульфатної кислоти з активністю йонів Н3О+, рівною, за температури 298 К, 1 моль/л. Платинову пластинку, покриту губчастою платиною, насичують воднем під тиском 101,3 кПа.
Електродні потенціали усіх електродів, виміряні відносно стандартного водневого електрода, складають ряд стандартних електродних потенціалів.
|
|
|
За величиною електродного потенціалу можна встановити напрямок перебігу електродної реакції. Будь-який електрод, розміщений вище в ряді стандартних електродних потенціалів, знаходиться в більш окисленому стані, ніж розміщений нижче. Якщо з двох таких електродів скласти гальванічний елемент, то на першому буде відбуватися реакція окиснення, на другому – відновлення.
Кількісна залежність між величиною потенціалу, співвідношенням концентрацій окисненої і відновленої форми і температурою виражається рівнянням Нернста-Петерса:
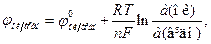
де а (ок) і а (відн) – відповідно активності окисненої та відновленої форм, n – кількість електронів, що беруть участь в електродному процесі.
Прийнята така класифікація електродів. Електроди першого роду, оборотні по катіону, потенціал яких обчислюють за рівнянням Нернста. До електродів першого роду відносять:
а) металічні електроди, наприклад, срібний Ag+ | Ag;
б) амальгамні металічні електроди, наприклад, кадмієвий Cd2+ | Cd;
в) газові електроди, наприклад, водневий H+ | Pt, Н2.
Електроди II роду складаються із металу, покритого його важкорозчинною сполукою (сіллю, оксидом, гідроксидом) і зануреного в розчин добре розчинної сполуки з тим же аніоном. Можна навести такі приклади електродів другого роду:
а) хлорсрібний електрод Ag, AgCl | Сl–;
б) каломелевий електрод Hg, Hg2Cl2 | Сl–.
Електроди третього роду менш поширені. Вони складаються з металу який контактує з двома важкорозчинними сполуками, що мають спільний аніон.
Окисно-відновні являють собою інертний метал занурений в розчин, що містить окислену і відновлену форми. Розрізняють прості і складні окисно-відновні електроди:
а) прості окисно-відновні електроди: Pt | Fe2+, Fe3+;
б) складні окисно-відновні електроди хінгідронний електрод: Pt | С6Н4О2, С6Н4(ОН)2, H+.
Йонселективні електроди (ЙСЕ) – це електроди в електродній реакції яких електрони участі не беруть, а їх потенціали визначаються процесами розподілу йонів між мембраною і розчином. Такі електроди дають змогу селективно визначати який-небудь йон в присутності інших йонів, їх називають йонселективними електродами (ЙСЕ). Першим представником ЙСЕ був електрод зі скляною мембраною – скляний електрод. Нині створені ЙСЕ на основі рідких та твердих іонітів, моно- і полікристалів, елементоорганічних сполук, мембраноактивних комплексонів. Широко застосовуються електроди, селективні до йонів К+, Na+, Тl+, NН4+, Са2+, Ва2+, Сd2+, Сu2+, Аg+, F–, Сl–, Вr–, І–, NО2–, СN–, ВF4–, SCN–, СlO4–, СО32–. Створені рідинні електроди для органічних йонів, ферментні та субстратні, а також газочутливі.
|
|
|
Схему селективного електрода можна записати у вигляді:

ЙСЕ
Мембрана розділяє два розчини (досліджуваний та стандартний), які містять йони, здатні проникати в мембрану і рухатися в ній. Стандартний розчин містить тільки один вид мембраноактивних йонів – А+. Склад стандартного розчину залишається незмінним. Досліджуваний розчин містить йони А+ і В+, склад його змінюється. Для потенціалу А+ селективного електрода Нікольський отримав рівняння:
jЙСЕ = const + θlg (a A+ + KА–В ∙ а В+),
де θ = 2,303RT/F, при Т = 298 К, θ = 0,059.
Це рівняння було виведене без урахування дифузійного потенціалу, який виникає в мембрані внаслідок різної рухливості йонів А+ і В+. В результаті врахування дифузійного потенціалу рівняння було перетворене:
jЙСЕ = const + θlg (a A+ + KА/В ∙ а В+).
За формою останні рівняння однакові. Але константа KА/В має більш складний зміст, ніж KА–В тому що містить множник, який ураховує роль відносних рухливостей йонів.
Одержане рівняння – основне рівняння теорії ЙСЕ, а величина KА/В – основна характеристика властивостей ЙСЕ. З одного боку, вона зв'язана з відносною рухливістю йонів в мембрані: чим більша рухливість заважаючого йона В+, тим більший його вплив на потенціал А+-селективного електрода. З другого боку, KА/В залежить від селективності поглинання мембраною йона при йонному обміні. Величину KА/В називають коефіцієнтом селективності ЙСЕ, або коефіцієнтом впливу йонів В+ на А+-функцію електрода.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 569; Нарушение авторских прав?; Мы поможем в написании вашей работы!