
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методи визначення порядку реакції
Дослідження залежності швидкості реакцій від різних факторів дає можливість інтенсифікувати технологічні процеси фармацевтичних виробництв. Експериментальне вивчення впливу температури та інших параметрів на швидкість розкладання біологічно- активних речовин дозволяє науково обґрунтовувати й визначати терміни придатності лікарських препаратів і парфумерно-косметичних засобів, знаходити фактори, що сприяють їх стійкості, обирати раціональну технологію їх виготовлення. Знання кінетичних законів хімічних процесів лежить в основі оптимізації пошуку біологічно активних речовин, оскільки дає можливість вивчати реакційну спроможність, установлювати механізми хімічної взаємодії і, таким чином, обирати оптимальні умови синтезу та аналізу. Фармакокінетичні дослідження, зв'язані з вивченням швидкості засвоєння і виведення лікарських препаратів в організмі, дозволяють інтерпретувати механізми їх фізіологічної дії.
ХІМІЧНА КІНЕТИКА І КАТАЛІЗ
Розділ 5
Хімічна кінетика – це розділ фізичної хімії, в якому вивчають швидкості та механізми хімічних перетворень, а також фактори, що впливають на них.
Швидкість хімічної реакції є число елементарних актів хімічної реакції, які відбуваються в одиницю часу в одиниці об'єму (для гомогенних реакцій) або на одиниці поверхні (для гетерогенних реакцій).
Швидкість хімічної реакції є зміна концентрації реагуючих речовин в одиницю часу. Математичне визначення середньої швидкості реакції в проміжок часу ∆τ записують наступним чином:

В різні проміжки часу середня швидкість хімічної реакції має різні значення; істинна (миттєва) швидкість реакції визначається як похідна від концентрації за часом
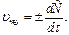
Швидкість хімічної реакції залежить від багатьох факторів: природи реагуючих речовин, їх концентрації, температури, природи розчинника і т.д.
В основі хімічної кінетики знаходиться основний постулат хімічної кінетики: швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, підведених до певних степенів.
Тобто для реакції
aA + bB + dD + … → продукти
вираз для швидкості реакції буде таким
u = k ∙ CAn1 ∙ CBn2 ∙ CDn3...
Коефіцієнт пропорційності k називається константою швидкості реакції. Константа швидкості чисельно дорівнює швидкості реакції за умови, що концентрації всіх реагуючих речовин дорівнюють одиниці. Константа швидкості залежить від природи реагентів, температури, каталізатора, але не залежить від концентрації. Її називають питомою швидкістю.
Залежність швидкості реакції від концентрацій реагуючих речовин визначають експериментально і має назву кінетичного рівняння хімічної реакції. Для того, щоб мати повний вигляд цього рівняння, експериментально визначають константу швидкості і показники степенів при концентраціях реагуючих речовин. Показники степенів n1, n2, n3 називаються порядком реакції за речовинами А, В, D, а їх сумарне значення n = n1 + п2 + п3 +... – загальним порядком реакції.
Порядок хімічної реакції– це формально-кінетичне поняття, фізичний сенс якого для елементарних (одностадійних) реакцій полягає в наступному: порядок реакції дорівнює кількості концентрацій, які одночасно змінюються. У випадку елементарних реакцій порядок реакції може дорівнювати сумі коефіцієнтів в стехіометричному рівнянні реакції; однак в загальному випадку порядок реакції визначається лише в експерименті і залежить від умов проведення реакції (порядок реакції може мати як цілочисельні так і дробові та від’ємні значення у складних реакціях).
Молекулярність реакції – число частинок, які, згідно експериментально встановленому механізму реакції, приймають участь в елементарному акті хімічної взаємодії.
Мономолекулярні – реакції, в яких відбувається хімічне перетворення однієї молекули (ізомеризація, дисоціація і т. д.):

Бімолекулярні – реакції, елементарний акт яких відбувається при зіткненні двох частинок (однакових або різних):
СН3Вr + KOH ® CH3OH + KBr.
Гідроліз сахарози на глюкозу і фруктозу (бімолекулярна, псевдопершого порядку):
С12H22O11 + HOH® C6H12O6 + C6H12O6.
Тримолекулярні – реакції, елементарний акт яких відбувається при зіткненні трьох частинок:
O2 + NO + NO → 2NO2
Реакції з молекулярністю більше, ніж три, невідомі.
Для елементарних реакцій, які відбуваються при приблизно рівних концентраціях вихідних речовин, величини молекулярності і порядку реакції співпадають. Але не існує чітко визначеного зв'язку між поняттями молекулярності і порядку реакції, оскільки порядок реакції характеризує кінетичне рівняння реакції, а молекулярність – механізм реакції.
Розглянемо реакції, для яких молекулярність і порядок збігаються і дорівнюють нулю, одиниці, двом, трьом.
Реакції нульового порядку. Частіше всього до реакцій нульового порядку належать реакції, які відбуваються на поверхні твердих тіл (гетерогенні реакції) за умови, що швидкість дифузії реагентів до поверхні є меншою за швидкість їх хімічного перетворення, тобто саме хімічна реакція є лімітуючою стадією процесу. Також до реакцій нульового порядку належать ферментні реакції, де кількість ферменту обмежена, а субстрат перебуває в надлишку.
Швидкість реакцій нульового порядку не залежить від концентрації реагуючої речовини в певному її інтервалі і визначається рівнянням:
υ = kc = k,
де k – константа швидкості реакції нульового порядку.
Константу швидкості реакції нульового порядку визначають за рівнянням:
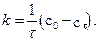
Розмірність k збігається з розмірністю швидкості реакції – моль/(дм3∙с).
Період напівперетворення,тобто час, за який прореагує половина реагенту:
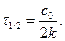
Реакції першого порядку. Швидкість реакції першого порядку визначається рівнянням:
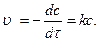
 Значення константи швидкості можна визначити графічним способом, побудувавши графік в координатах ln c – τ, значення k чисельно дорівнює тангенсу кута нахилу прямої, взятому з протилежним знаком:
Значення константи швидкості можна визначити графічним способом, побудувавши графік в координатах ln c – τ, значення k чисельно дорівнює тангенсу кута нахилу прямої, взятому з протилежним знаком:
 0 τ
0 τ
|
Пряма відсікає на осі ординат відрізок, рівний ln с0. Відповідно формула для розрахунку k:
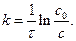
Розмірність константи швидкості – зворотній час – [k] = τ-1 (с-1, хв-1 тощо).
Період напівперетворення для реакції першого порядку описується рівнянням:

Тобто, для реакцій першого порядку період напівперетворення не залежить від початкової концентрації реагенту. Це характерна ознака таких реакцій.
Реакції другого порядку. Для реакції другого порядку швидкість визначається рівнянням:

Вираз для розрахунку поточної концентрації в довільний момент часу:

Експериментальні дослідження реакції другого порядку вказують на лінійну залежність величини зворотної концентрації реагентів від часу:
 τ
τ
|
 Константа швидкості реакції дорівнює тангенсу кута нахилу прямої і визначається за рівнянням:
Константа швидкості реакції дорівнює тангенсу кута нахилу прямої і визначається за рівнянням:
Розмірність константи швидкості реакції другого порядку [k] = л ∙ моль-1 ∙ с -1.
Період напівперетворення для реакцій другого порядку обернено пропорційний початковій концентрації:

Реакції третього порядку. Для реакції третього порядку швидкість залежить від концентрації реагуючих речовин у третій степені:

Вираз для обчислення концентрації реагенту в довільний момент часу:

Отже, одержали лінійне рівняння в координатах 1/с2 – τ:
 0 τ
0 τ
|
Константа швидкості дорівнює tga/2 і визначається за рівнянням:

Розмірність константи швидкості реакції другого порядку [k] = л2 ∙ моль-2 ∙ с -1.
Період напівперетворення розраховують за формулою:
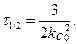
Тобто, період напівперетворення обернено пропорційний квадрату початкової концентрації.
Інтегральний метод підбору кінетичного рівняння. Експериментальні значення поточної концентрації і часу підставляють в рівняння для констант швидкостей реакцій різних порядків. Рівняння, за яким одержують сталі значення константи швидкості, описує кінетику досліджуваного процесу.
Іншим варіантом цього методу є подання експериментальних значень с і τ у координатах, що дають лінійні залежності. Для реакції першого порядку графік буде лінійним в координатах lnс – τ, другого порядку – в координатах 1/с – τ, третього порядку – в координатах 1/с2 – τ.
Інтегральний метод періоду напівперетворення. Вивчають залежність періоду напівперетворення від початкової концентрації реагуючої речовини. Для реакцій першого порядку τ1/2 не залежить від с0, для реакцій другого порядку він обернено пропорційний с0, для реакцій третього порядку – обернено пропорційний со2.
 τ
τ
|
Диференційний метод Вант-Гоффа. Прологарифмуємо рівняння для швидкості реакції
υ = k c n
одержимо ln υ = ln k + n lnc рівняння прямої в координатах ln υ – ln c, тангенс кута нахилу якої дорівнює порядку реакції n. Отже, визначаючи швидкість реакції при різних концентраціях реагуючої речовини, можна знайти порядок реакції.
Для визначення швидкості реакції будують кінетичну криву в координатах с – τ (рис). Швидкість реакції дорівнює тангенсу кута нахилу дотичної до кривої в даній точці, яка відповідає певній концентрації.
|
|
Дата добавления: 2015-05-23; Просмотров: 6940; Нарушение авторских прав?; Мы поможем в написании вашей работы!