
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Будова атома
|
|
|
|
Атоми металічних та неметалічних елементів відрізняються між собою будовою, а тому і властивостями. З чого складається атом? Атом складається з електронів та ядра, що містить у собі протони і нейтрони. Схематично модель будови атома можна представити так:
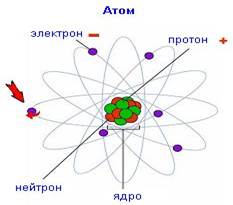
Рис.1.1 Модель будови атома
Нейтрони заряду не мають, протони – заряджені позитивно, тому загальний заряд ядра атома завжди додатній «+». Електрони – це від’ємно заряджені частинки «-», що рухаються навколо ядра. Кількість протонів та електронів в атомі рівна, тому атом в цілому – електронейтральний.
Атоми одного і того самого хімічного елемента – однакові, атоми різних хімічних елементів різні між собою. Номер хімічного елемента у періодичній таблиці, співпадає з кількістю електронів та протонів в атомі. Наприклад порядковий номер Алюмінію (Al) – 13, це означає, що атом цього елемента містить 13 електронів та 13 протонів, заряд ядра +13.
Взаємозв’язок будови атома та його місця розташування в періодичній таблиці
У періодичній таблиці елементи розташовуються в порядку зростання заряду ядра, займаючи кожний своє положення в періодах та групах. Період – це горизонтальний ряд хімічних елементів, розташованих в порядку зростання заряду ядра, в межах кожного періоду спостерігається поступова зміна хімічних властивостей елементів від металічних до неметалічних. Група - вертикальний стовпчик періодичної таблиці, у якому елементи з однаковою валентністю та подібними хімічними властивостями розташовані один під одними.
Всього вирізняють 7 періодів та 8 груп. Номер періоду вказує на кількість енергетичних рівнів (оболонок) в атомі, а номер групи вказує на валентність, тобто кількість електронів зовнішнього енергетичного рівня, що можуть утворювати хімічний зв'язок з іншими атомами.
|
|
|
|

|
|

|
|
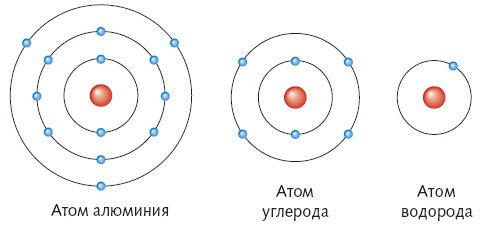
Рис.1.2 Приклад будови атомів
Якщо уважно розглянути будову періодичної таблиці, можна побачити, що основна кількість металічних елементів розташовується у І, ІІ та ІІІ, рідше ІV групі, це означає те, що метали мають 1, 2 або 3 валентні електрони. Неметалічні елементи мають від 3 до 7 електронів зовнішнього енергетичного рівня. Тому під час утворення сполук (виникнення хімічного зв’язку між атомами) метали, як правило будуть віддавати свої валентні електрони, а неметали, забиратимуть їх. Віддаючи або приймаючи електрон, атом втрачає свою нейтральність, перетворюється на «+» або «-» заряджену частинку: катіон або аніон.
Періодичний закон встановлює взаємозалежність між будовою атомів та їхніми хімічними властивостями.
Періодичний закон Д.І. Менделєєва: властивості елементів, а відповідно і властивості утворених ними простих і складних* речовин перебувають у періодичній залежності від величини заряду ядра їх атома.
Прості речовини – це такі речовини, які складаються з атомів одного і того самого хімічного елементу (Н2,О2,Сl2).
Складні речовини – це такі речовини, які складаються з атомів різних хімічних елементів (H2O, H2SO4, NaCl, C2H5OH).
1.2 Основні класи неорганічних сполук
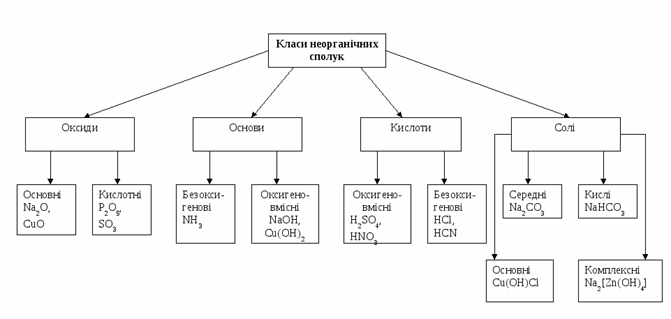
Усі неорганічні сполуки, які існують в природі, поділяють на чотири класи: кислоти, основи, оксиди, солі. Вони відрізняються між собою за властивостями та складом.
Табл.1.1 Основні клас неорганічних сполук
| Оксиди | Основи | Кислоти | Солі |
| це неорганічні сполуки, які складаються з двох хімічних елементів, одним із яких є Оксиген | це неорганічні сполуки, які складаються з металу та гідроксильної групи ОН | це неорганічні сполуки, які складаються з Гідрогену та кислотного залишку | це неорганічні сполуки, які складаються з металу та кислотного залишку |
|
|
|
Рис.1.3 Класифікація неорганічних сполук
Табл.1.2 Таблиця кислот 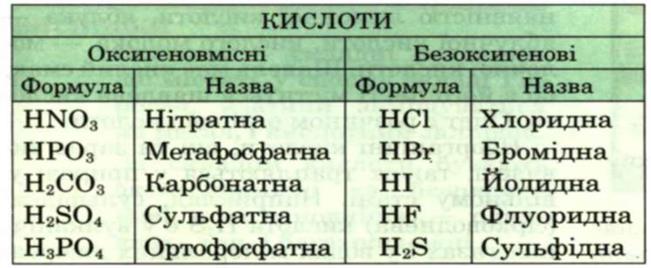
Розділ 2. Метали і сплави
2.1 Загальна характеристика металів. Фізичні властвості металів
Металічні елементи займають в основному ліву нижню частину Періодичної системи хімічних елементів Д. І. Менделєєва. До металічних елементів належать ті елементи, в чиїх атомах на зовнішньому електронному рівні перебуває невелике (від одного до чотирьох) число електронів, які атоми можуть легко віддавати.
Метали мають низку Загальних фізичних властивостей:
— електропровідність;
— теплопровідність;
— металічний блиск;
— пластичність (ковкість);
— зазвичай високу твердість;
— найчастіше перебувають у твердому агрегатному стані.
Про приналежність речовини до металів не можна судити тільки за однією ознакою. Так, деякі неметали можуть проводити електричний струм (графіт), мають металічний блиск (йод), мають пластичність (пластична сірка). Таким чином, відносити ту чи іншу просту речовину до металів або неметалів можна тільки за сукупністю ознак.
Загальні фізичні властивості металів (електропровідність, теплопровідність, блиск тощо) пояснюються наявністю рухливих електронів, інакше кажучи, особливим характером металічного зв’язку.
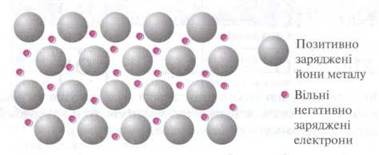
Рис.2.1 Схематичне зображення будови кристалічної решітки металів
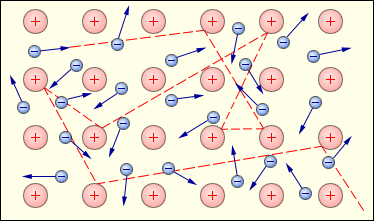
Рис. 2.2 Схематичне зображення хаотичного руху вільних електронів («електронного газу») між вузлами кристалічної решітки
Однак різні метали все-таки мають різні фізичні властивості, такі, як температура плавлення, густина тощо. Ці властивості багато в чому залежать від кристалічних структур металів.
Завдяки металічному зв’язку окремі шари в кристалах металів можуть зміщуватися відносно один одного. Це надає металам пластичності (ковкості) — здатності змінювати свою форму без розриву хімічних зв’язків.
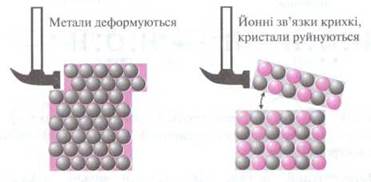
Рис.2.3 Порівняння процесів деформації речовин з магічно. та йонною кристалічними гратками
Найбільш ковким металом є золото — з 1 г золота можна витягнути дріт завдовжки 2,4 км і завтовшки в кількасот разів менший від товщини волосся. Водночас метал сурма дуже крихкий — його навіть можна розтирати на порошок у ступці.
|
|
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 9096; Нарушение авторских прав?; Мы поможем в написании вашей работы!