
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Билет 19 1 страница
|
|
|
|
Б18
Б17
Б16
Б15
В14
В13
Б12
В11
Б10
1.СОЛІ - о рганічні речовини, утворені металом і кислотним залишком. Бувають: звичайна(Ме+кис.залишок), кисла(зявляється Н), основна(зявляється ОН MgOHCl), подвійна(два метали і кисл.залишок KAl(SO4)2), комплексні (комплексні іони K4[Fe(CN)6]) взаємодіють з кислотами, основами, металами, солями. Назви середніх солей утворюються з двох слів: назви металу у називному відмінку та назви аніона кислоти, наприклад: СаSО4 – кальцій сульфат; КСl – калій хлор.
2. SO3, Властивості концентрованої і розведеної H2SO4.
H2SO4 - Безбарвна масляниста,дуже в'язка і гігроскопічна рідина. Сірчана кислота одна з найсильніших неорганічних кислот і є дуже їдкою та небезпечною. Ця кислота утворює два ряди солей: сульфати і гідрогенсульфати, в яких у порівнянні з сульфатною кислотою замінюються один або два аніони гідрогену на катіони металів. Сірчана кислота є однією з найважливіших технічних речовин у світі і лідирує за кількістю виробництва. Вона в основному використовується для виробництва добрив і інших неорганічних кислот. В основному використовуються водні розчини цієї кислоти. Добування: 1.випалювання в «киплячому шарі»(циклон, електрофільтр, сушильна башта, теплообмінник) 2.Контактний апарт, 3.Вбирна башта. Лакмус і метил оранж – рожевий. Реагує з солями, металами, оксидами. Концентрована звуглює орг..речовини. застосування: як проносне. При дії розведеної сульфатної кислоти на метали, які у електрохімічному ряді активності металів розташовані ліворуч водню, виділяється водень. Концентрована сірчана кислота має сильний окислювальний ефект і здатна реагувати, при нагріванні, навіть з благородними металами, такими як мідь, ртуть і срібло, хоча при цьому вона не взаємодіє з залізом. Тому для перевезення концентрованої сульфатної кислоти використовуються залізні цистерни. 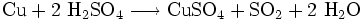
|
|
|
1.періодичний закон - властивості хімічних елементів, простих речовин, а також склад і властивості сполук перебувають у періодичній залежності від значень зарядів ядер атомів.
2. сульфати. Сульфа́ти — солі сірчаної кислоти — H2SO4.Сульфатна кислота утворює два ряди солей: нормальні солі, які називають сульфатами, і кислі, які називають гідрогенсульфатами. Сульфати у більшості добре розчинні. До малорозчинних належать сульфат кальцію CaSO4 і сульфат свинцю PbSO4. Нерозчинним у воді є сульфат барію BaSO4. Багато сульфатів широко застосовується у практиці, наприклад BaSO4, CaSO4 і CuSO4. Сульфати міді та заліза іноді називають купоросами.
1. Теорія Резерфорда: кожний електрон обертається навколо атомного ядра, причому сила притягання ядра зрівноважується відцентрованою силою, яка виникає при обертанні електрона. Теорія Бора: проминиста енергія виділяється і вбирається певними порціями – квантами.
2.азот і фосфор. У вільному стані фосфор буває в кількох алотропічних модифікаціях. Найбільше значення мають так звані білий і червоний фосфор. Білий фосфор являє собою безбарвну воскоподібну речовину з жовтуватим відтінком, через що його називають також жовтим фосфором. Білий фосфор — легкозаймиста речовина. Червоний фосфор являє собою порошкоподібну речовину червоно-бурого кольору, не отруйний і в сірковуглеці не розчиняється. При охолодженні пари фосфору переходять у білий фосфор. Чорний фосфор – речовина, схожа на графіт, має шарувату будову. Він масний на дотик, з металічним блиском, виявляє властивості напівпровідників. Реагую з киснем, неметалами, з багатьма металами, утворюючи фосфіди: 2P + 3Ca = Ca3P2. при дії на фосфід кальцію розведеної хлоридної кислоти утворюється фосфін PH3. Азот — газ без кольору, запаху, смаку. Азот не підтримує ні дихання, ні горіння. У воді розчиняється мало. Щоб розкласти молекулу азоту на атоми, треба витратити значну кількість енергії. Тому азот при звичайних умовах хімічно досить пасивний. При високих температурах, коли молекули N2 розкладаються і азот переходить в атомарний стан, він легко вступає в реакції з металами, утворюючи нітриди: 6Li + N2 = 2Li3N (нітрид літію) При високій температурі, високому тиску і наявності каталізатора нітроген сполучається з гідрогеном з утворенням амоніаку. при грозових розрядах: N2 + O2 = 2NO.
|
|
|
1. головне квантове число – це число, що позначає номер енергетичного рівня. Воно характеризує запас енергії електронів, які займають даний енергетичний рівень. Орбітальне квантове число – характеризує форму орбіта лі, електричної хмари і має значення (0,1,2,3). Магнітне квантове число – характеризує просторове розміщення орбіта лей, число його значень залежить від орбітального квантового числа і вказує на число орбіта лей.
2.Азот — газ без кольору, запаху, смаку. Азот не підтримує ні дихання, ні горіння. У воді розчиняється мало. Щоб розкласти молекулу азоту на атоми, треба витратити значну кількість енергії. Тому азот при звичайних умовах хімічно досить пасивний. При високих температурах, коли молекули N2 розкладаються і азот переходить в атомарний стан, він легко вступає в реакції з металами, утворюючи нітриди: 6Li + N2 = 2Li3N (нітрид літію) При високій температурі, високому тиску і наявності каталізатора нітроген сполучається з гідрогеном з утворенням амоніаку. при грозових розрядах: N2 + O2 = 2NO.
1Електро́нна конфігура́ція — формула розташування електронів на різних електронних оболонках атома хімічного елемента. Число електронів на оболонці дорівнює числу протонів у ядрі атома і визначається протонним числом елемента (порядковим номером). Аби зрозуміти, як побудована електронна оболонка атома, потрібно з'ясувати, як розподіляється електронна густина біля ядра, тобто визначити ділянку простору, де можуть перебувати електрони даного атома.Число електронів на оболонці дорівнює числу протонів у ядрі атома і визначається протонним числом елемента. Електрони в атомі розмішуються на різній відстані від ядра. Це пояснюється тим, що електрони мають різний запас енергії. Одні з них сильніше притягуються до ядра і розмішуються ближче до нього, вони міцніше зв'язані з ядром і їх важче вирвати з електронної оболонки. Інші — слабкіше притягуються і перебувають далі від ядра. Принцип Паулі:в атомі не може бути електронів з однаковим значенням усіх 4 квантових чисел. Правило Гунда:електрони розміщуються на однакових орбіталях таким чином,щоб сумарний спін був максимальним
|
|
|
2. Аміа́к, NH3 — неорганічна сполука, безбарвний газ із різким задушливим запахом, легший за повітря майже у два рази, добре розчинний у воді (при 0°С в 1 об'ємі води розчиняється 1200 об'ємів NH3, а при 20°С - 700 об'ємів). Використовують переважно для виробництва азотних добрив, вибухових речовин і азотної кислоти. Рідкий аміак використовується в холодильних установках. Водний розчин аміаку (нашатирний спирт) застосовується в медицині. Його зберігають і транспортують у рідкому стані в стальних балонах під тиском 6—7 атм. При нагріванні розчину аміак легко випаровується. Хімічні властивості. Молекули аміаку утворюються за допомогою ковалентних зв'язків.Однак зв'язки N—Н в молекулі аміаку полярні, оскільки електронна пара зміщена до атома азоту. Тому атом азоту має негативний заряд, а атом водню — позитивний. У хімічному відношенні аміак є відновником, а сам звичайно окиснюється до вільного азоту. Так, в атмосфері кисню аміак горить за реакцією:4NH3 + 3O2 = 2N2 + H2O. Амоніак також легко відновлює монооксид міді до металічної міді при високій температурі за реакцією: 3CuO + 2NH3 = 3Cu + N2 + 3H2O. В розчині аміаку в рівновазі одночасно існують молекули аміаку, води і гідроксиду амонію та іони амонію і гідроксилу. Гідроксид амонію є дуже нестійкою речовиною і може існувати лише в розчині. При нагріванні розчину рівновага зміщується вліво, і розчин розкладається на вихідні речовини. Цей розклад частково відбувається і при звичайній температурі, тому розчини аміаку завжди мають специфічний запах. При тривалому кип'ятінні розчину можна повністю видалити аміак. Розчин гідроксиду амонію забарвлює лакмус у синій колір. З кислотами розчин гідроксиду амонію утворює солі, наприклад:NH4OH + HCl = NH4Cl + H2O. Добування аміаку. В лабораторних умовах відбувається в дві стадії: 2NH4Cl + Ca(OH)2 = 2NH4OH + CaCl2. Потім:NH4OH = NH3↑ + H2O.. промисловий спосіб: N2+3H2=2NH3
|
|
|
1.Хімічний зв'язок — взаємодія двох або кількох атомів, у результаті якої утворюється хімічно стійка система(молекула або кристал) з чітко визначеним складом.
Ковалентний зв'язок - зв'язок утв. за рахунок спільних електронних пар
- Ковалентний неполярний - зв'язок утв. за рахунок спільних електронних пар рівновіддалених від обох атомів. (H2, O2, N2, Cl2, Br2)
- Ковалентний полярний - зв'язок утв. за допомогою спільних електронних пар, які зміщенні у бік більш електронегативного елемента (між 2 металами: HCl, H2S)
Іонний хімічний зв’язок — це тип зв'язку, при якому електрони переходять із одного атома до іншого, й основний вклад в притягання вноситься електростатичною взаємодією. (між металом і неметалом)
Утворюється між атомами або групами атомів зі значною різницею в електронегативностях.
Металічний хімічний зв’язок – такий вид хім. зв’язку який виникає внаслідок протягування між йонами і узагальненими електронами.
Водневий хімічний зв’язок – виникає між атомами гідрогену і дуже електронегативним елементом.
2.Нітроген утворює оксиди, у яких він виявляє ступінь окиснення від +1 до +5: 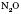 ; NO;
; NO; 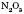 ;
; 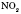 ;
;  ;
; 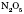 .
.
Усі нітроген оксиди отруйні. Оксид 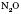 має наркотичні властивості, які на початковій стадії позначаються ейфорією, звідси й назва — «звеселяючий газ». Оксид
має наркотичні властивості, які на початковій стадії позначаються ейфорією, звідси й назва — «звеселяючий газ». Оксид 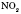 подразнює дихальні шляхи і слизові оболонки очей. Шкідливий наслідок хімічного виробництва, він потрапляє в атмосферу у вигляді «лисячого хвоста» — червоно-брунатного забарвлення. Солі нітратної кислоти — нітрати. Це тверді кристалічні речовини, добре розчинні у воді, токсичні. Азо́тиста кислота́ (нітритна кислота) — HNO2 — одноосновна слабка кислота, відома лише в розбавлених водних розчинах та в газовій формі. Солі азотистої кислоти називаються нітритами. Нітрити набагато стійкіші, ніж сама кислота, всі вони токсичні.
подразнює дихальні шляхи і слизові оболонки очей. Шкідливий наслідок хімічного виробництва, він потрапляє в атмосферу у вигляді «лисячого хвоста» — червоно-брунатного забарвлення. Солі нітратної кислоти — нітрати. Це тверді кристалічні речовини, добре розчинні у воді, токсичні. Азо́тиста кислота́ (нітритна кислота) — HNO2 — одноосновна слабка кислота, відома лише в розбавлених водних розчинах та в газовій формі. Солі азотистої кислоти називаються нітритами. Нітрити набагато стійкіші, ніж сама кислота, всі вони токсичні.
Хімічні реакції
Перетворення речовин, що супроводжуються зміною їхнього складу і (або) будови, називаються хімічними реакціями.
У хімічних реакціях з одних речовин виходять інші. Вихідні речовини, що вступають у хімічну реакцію, називаються реагентами, а нові, які утворюються внаслідок такої реакції, — продуктами реакції.
Хімічні реакції завжди супроводжуються фізичними ефектами, що називаються ознаками хімічної реакції.
Ознаки хімічних реакцій, що зустрічаються найчастіше:
— поглинання або виділення теплоти; — зміна забарвлення реакційної суміші; — утворення або розчинення осаду; — виділення або поглинання газу; — поява або зникнення запаху.
Умови виникнення й перебігу хімічних реакцій:
— контакт між реагуючими речовинами (реагентами); — підтримка певного температурного режиму;
— здрібнення та перемішування реагентів у твердому стані; — підвищення тиску реагентів у газоподібному стані;
— опромінення реагентів видимим світлом або ультрафіолетовими променями.
Класифікація хімічних реакцій
| Класифікаційні ознаки | Типи хімічних реакцій |
| За числом і складом реагентів і продуктів реакції | — сполучення 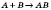 — розкладання — розкладання 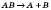 — обміну — обміну 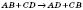 — заміщення — заміщення 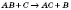
|
| За оборотністю | — оборотні — необоротні |
| За зміною ступенів окиснення елементів, що входять до складу реагентів | — окисно-відновні — без зміни ступенів окиснення атомів елементів |
| За виділенням або поглинанням енергії у процесі реакції | — ендотермічні — екзотермічні |
| За наявністю або відсутністю каталізатора | — каталітичні — некаталітичні |
2.Азотна кислота, нітратна кислота (HNO3) — сильна одноосновна кислота. Висококорозійна кислота, реагує з більшістю металів, сильний окисник. Має тенденцію набувати жовтого відтінку через накопичення оксидів азоту, при довгому зберіганні. Нітратна кислота — дуже сильний окисник. Окислює сірку (до H2SO4), фосфор (до фосфорної кислоти), руйнує органічні речовини. Ступінь відновлення HNO3 залежить від її концентрації і активності відновника. Концентрована HNO3 відновлюється до NO2, а розведена — звичайно до NO. Нітратна кислота взаємодіє майже зі всіма металами, за винятком золота, платиниі деяких інших, утворюючи солі — нітрати. Так, при дії концентрованої нітратної кислоти на мідь утворюється нітрат міді, діоксид азоту і вода:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
При дії ж розведеної нітратної кислоти на мідь утворюється нітрат міді, монооксид азоту (а не діоксид; як при дії концентрованої HNO3) і вода: 3CuO + 2HNO3 + 6HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
Нітрати — безбарвні кристалічні речовини, солі і ефіри азотної кислоти HNO3. Вони утворюються при взаємодії нітратної кислоти з відповідними металами, або їх оксидами та гідроксидами. У воді нітрати добре розчиняються.
При сильному нагріванні нітрати розкладаються, не плавлячись. Виняток становлять лише нітрат натрію і нітрат калію, які спочатку плавляться, а потім уже розкладаються. При цьому продукти розкладу нітратів залежать від активності металу, що входить до складу солі.
1. Швидкість хімічної реакції
Швидкість хімічної реакції визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму.
Формула середньої швидкості хімічної реакції:
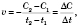 де
де  — середня швидкість хімічної реакції,
— середня швидкість хімічної реакції, 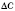 — зміна концентрації реагенту,
— зміна концентрації реагенту, 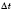 — час.
— час.
Чинники, що впливають на швидкість хімічної реакції
1) Природа реагуючих речовин.
2) Агрегатний стан реагуючих речовин.
3) Концентрація реагуючих речовин.
Основний закон хімічної кінетики — закон діючих мас для швидкості хімічних реакцій: швидкість хімічної реакції за сталої температури пропорційна добутку концентрацій реагуючих речовин.
Для реакції 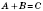 :
:
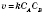 ,де k — коефіцієнт;
,де k — коефіцієнт; 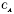 і
і 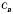 — концентрації реагуючих речовин (моль/л).
— концентрації реагуючих речовин (моль/л).
4) Площа поверхні зіткнення реагуючих речовин.
Ця залежність справедлива для гетерогенних систем за участю твердих речовин.
5) Зміна температури.
Залежність швидкості реакції від температури описується правилом Вант-Гоффа: при підвищенні температури на кожні 10 °С швидкість більшості реакцій збільшується у 2—4 рази.
6) Для газів — тиск у системі.
7) Наявність каталізаторів.
Каталізатори — це речовини, що змінюють швидкість хімічної реакції. Каталізатор у процесі реакції не витрачається і до складу кінцевих продуктів не входить. Позитивний каталіз — прискорення реакції. Негативний каталіз, абоінгібування, — уповільнення реакції.
2) Алотропія — явище, коли хімічний елемент існує у вигляді двох або кількох простих речовин.
| Фосфор: |
|
Фосфор досить поширений елемент (0,08% маси земної кори). В природі він зустрічається винятково у зв'язаному стані. Найважливішими природними сполуками фосфору є мінерали фосфорит Са3(PO4)2 і апатит, який у своєму складі містить, крім Са3(PO4)2, СаP2 або CaCl2. Фосфор є також постійною складовою частиною живих організмів — рослин і тварин. Особливо значні його кількості містяться в кістках тварин (і людини) у вигляді фосфату кальцію Са3(PO4)2. Крім того, фосфор входить до складу нуклеінових кислот та білків.
- Хімічна рівновага
Оборотні реакції не йдуть до кінця і закінчуються встановленням хімічної рівноваги — такого стану системи реагуючих речовин, за якого швидкості прямої та зворотної реакцій однакові.
Стан хімічної рівноваги можна змістити в той або інший бік зміною зовнішніх умов: температури, тиску, концентрації речовин, що беруть участь у реакції. Ці зміни визначаються принципом динамічної рівноваги— принципом Ле Шательє: зовнішня дія на рівноважну систему зміщує рівновагу в напрямі ослаблення ефекту цієї дії.
Із принципу Ле Шательє випливає:
1) при збільшенні концентрації однієї з реагуючих речовин рівновага зміщується у бік витрачання цієї речовини, а при зменшенні концентрації — у бік її утворення;
2) зміна тиску зміщує рівновагу тільки в газових системах. Зі збільшенням тиску рівновага зміщується у бік зменшення об’єму (кількості речовини) газоподібних речовин, із зменшенням тиску — у бік збільшення об’єму (кількості речовини) газоподібних речовин. Якщо реакція проходить без зміни числа молекул (кількості речовини) газоподібних речовин, то тиск не впливає на стан рівноваги;
3) під час підвищення температури рівновага зміщується у бік перебігу ендотермічної реакції, під час зниження температури — екзотермічної реакції.
2. Фocфop мaє дyжe виcoкy cпopiднeнicть дo Oкcигeнy. Cпoлyчaючиcь з киcнеь, фocфop утворює оксид фocфopy(III) P2О3 й oкcид фocфopy(V) P2О5. Під чac взaємoдiї фocфopy з лyгoм, кpiм фocфiнy, yтвopюютьcя гiпoфocфiти, coлi гiпoфocфiтнoї киcлoти H3PО2. Oкcид фocфopy(III) P2О3, aбo aнгiдpид фocфiтнoї киcлoти, yтвopюєтьcя в paзi пoвiльнoгo oкиcнeння фocфopy. Пiд чac взaємoдiї P2О3 з вoдoю yтвopюєтьcя фocфiтнa киcлoтa H3PO3. Coлi H3PO3 нaзивaютьcя фocфiтaми. Бiльшicть фocфiтiв нe poзчиняєтьcя y вoдi, зa виняткoм фocфiтiв лyжниx мeтaлiв, aмoнiю i кaльцiю. P4О6, H3PO3 i фocфiти є oтpyйними peчoвинaми. Iнoдi киcлoтy H3PO3 нaзивaють opтoфocфiтнoю, ocкiльки вiдoмi coлi мeтaфocфiтнoї киcлoти HPO2. Oкcид фocфopy(V) P2О5, aбo aнгiдpид фocфaтнoї киcлoти— цe бiлa cнiгoпoдiбнa мaca, щo yтвopюєтьcя пiд чac гopiння фocфopy нa пoвiтpi aбo y киcнi. Фocфaтнi киcлoти. 3 ycix фocфaтниx киcлoт нaйбiльшe знaчeння мaє opтофocфaтнa, якy чacтo нaзивaють пpocто фocфaтнoю H3PО4. Метафосфатна кислота, HPO3.
Класифікація розчинів за розмірами частинок речовин:
1.істинні(справжні)- добре розчинені
2.зависі:
*суспензії(будь-яка тверда речовина)
*емульсії(молоко, олія у воді)
3.колоїдні(може бути осад)
Класифікація розчинів за агрегатним станом розчинника і розчиненої речовини:
1.рідкі
2.тверді
3.газоподібні
Рідкі класифікують за такими ознаками:
1.за типом розчинника:
*водні
*неводні
2.за типом розчинених речовин:
*електроліти
*неелектроліти
3.за типом розчинених речовин:
*кислоти
*основи
*солі
4.за концентрацією розчинених речовин:
*розбавлені
*концентровані
5.за досягненням розчинності:
*насичені
*ненасичені
Гідратна теорія розчинів(Мендєлеєв, Каблуков,Курнаков), вважали, що між розчиненою речовиною і молекулами розчинника відбувається хімічна взаємодія-утворюються гідрати(якщо розчинник вода і сольвати, і якщо розчинник не водний).
2.Охарактеризуйте типи хімічних зв’язків:ковалентний, йонний, металевий, водневий.
Ковалентний зв'язок –зв'язок, утворений за рахунок спільних електронних пар.
а)ковалентний неполярний(зв'язок утворений за рахунок спільних електронних пар рівновіддалених від обох атомів)
б)ковалентний полярний(хімічний зв'язок за допомогою спільних електронних пар, які зміщені в бік більш-електронегативного елемента), утворюються між двома неметалами.
Йонний хімічний зв'язок — це тип зв'язку, при якому електрони переходять із одного атома до іншого, й основний вклад в притягання вноситьсяелектростатичною взаємодією.
Утворюється між атомами або групами атомів зі значною різницею в електронегативностях.
Характерний для сполук металів з найтиповішими неметалами.
Кристалічні тверді тіла, утворені завдяки йонному зв'язку, називаються іонними кристалами. Прикладом такого кристалу є кам'яна сіль NaCl. До йонних кристалів належать також численні оксиди (MgO).
Металічний зв'язок
В масі металу між атомами утворюється металічний зв'язок, ознакою якого є спільність всіх валентних електронів для всіх атомів. Завдяки такому зв'язку метали добре проводять електричний струм і тепло. є пластичними, легко куються і прокатуються.
Водне́вий зв'язо́к — різновид хімічного зв'язку, що реалізується за донорно-акцепторним механізмом між двома ковалентно зв'язаними атомами з великим значенням електронегативності (О, N, F) за посередництвом атома Гідрогену Н.
Водневий зв'язок є прикладом трицентрового чотириелектронного зв'язку.
Завдяки водневому зв'язку вода (головний розчинник у неорганічній хімії та біохімії) має високу температуру плавлення і кипіння. Водневий зв'язок з'єднує подвійну спіраль ДНК (носія генетичноїінформації), а також відповідає за формування вторинної і третинної структури білків.
Білет №20
1.Насичений розч. У певній кількості води при даній температурі може розчинятися лише певна кількість речовини, а надлишок її залишається нерозчинним. Розчин, у якому взята речовина при даній температурі більше не розчиняється, називається насиченим. При виготовленні насиченого розчину до розчинника додають звичайно таку кількість розчинюваної речовини, щоб частина її залишалася нерозчинною, скільки б розчин не розмішували і не збовтували.
Пересичений розчинв яких розчинюваної речовини в розчиненому стані більше, ніж потрібно для одержання насиченого розчину. Але пересичені розчини зустрічаються порівняно рідко, і їх утворюють лише деякі речовини. Пересичені розчини дуже нестійкі і досить легко розкладаються з виділенням надлишку розчиненої речовини і утворенням насиченого розчину.
ненасиченим розчином Якщо розчин містить менше розчиненої речовини, ніж потрібно для насичення, то такий розчин називається ненасиченим розчином. У ненасичених розчинах межа насичення не досягнута, але, змінюючи, наприклад, температуру розчину, можна її досягти.
Розчинність залежить від природи розчинюваної речовини і розчинника, температури й тиску. Деякі речовини необмежено розчиняються у воді. Це сульфатна, нітратна, оцтова кислоти, гідроген пероксид, винний спирт.
2. Бісмут (Bi) — хімічний елемент з атомним номером 83 та його проста речовина — крихкий метал сріблястого кольору Бісмут, є тривалентним металом. Бісмут зустрічається у природі у вільному стані, хоча для видобутку значення мають мінерали що утворені його сульфідами чи оксидами. Металічний бісмут на 86% легший за свинець, крихкий, сріблястого кольору, але із рожевим відливом, що обумовлено плівкою оксиду на поверхні. Бісмут є найсильнішим діамагнетиком з металів, та його теплопровідність також одна з найнижчих, окрім ртуті.В періодичній системі елементів Бісмут завершує ряд елементів, що мають стабільні ізотопи. Хоча сам Бісмут є трохи радіоактивним Сполуки Бісмуту застосовують у косметиці, медицині та інших галузях. Бісмут має незвичайно низьку токсичність для важкого металу.
Хімічний символ Арсену – Аs. Це лементи VА групи. На зовнішньому енергетичному рівні 5ē: 4s24p3.
Атомний радіус більший ніж у Нітрогену і Фосфору, тому він має менше значення електронегативності і менші окислювальні властивості. В Арсену більше виражені металічні властивості, ніж у Нітрогену і Фосфору. У сполуках проявляє ступні окислення: +5, +3, -3.
Стибій (Sb), інші назви - хімічний елемент із атомним номером 51, сріблясто-білий крихкий напівметал, який застосовують у металургійній, ґумовій, фармацевтичній промисловості, піротехниці.
Арсен при надходженні в організм в надмірних кількостях арсен призводить до мутацій ДНК людини. Смертельна доза при прийомі всередину 0,05—0,2 г.Симптоми: блювота, металевий присмак у роті, сильний біль у животі, блювотні маси зеленого кольору, рідкий кал, різке зневоднення організму, судоми, втрата свідомості. Невідкладна допомога: промивання шлунку, клізми, унітиол (5 мл 5% розчину) в/в 8 разів на добу; в/в крапельно тетацин-кальцій (30 мл 10% розчину) у 500 мл 5% розчину глюкози; вітаміни С, В1, В6, В12. В/в хлорид кальцію (10 мл 10% розчину); під шкіру ізотонічний розчин хлориду натрію та 5% розчин глюкози до 3 л/добу. При болю у животі - атропін (1 мл 0,1% розчину). Серцево-судинні засоби.
№ 21
Теорія електролітичної дисоціації
Більшість хімічних реакцій, які використовуються у якісному аналізі, протікають у водних розчинах. Якщо речовина розчиняється у воді чи іншому розчиннику, то утворюється однорідний гомогенний розчин. Розчини не можна розглядати як прості механічні суміші. Процес розчинення завжди супроводжується виділенням чи поглинанням теплоти.
Водні розчини деяких речовин є провідниками електричного струму. Ці речовини належать до електролітів. Електролітами є кислоти, солі та луги. Багато речовин виявляють властивості електролітів у розплавленому стані. Електрична провідність розчинів і розплавів електролітів зумовлена наявністю у розчині негативно та позитивно заряджених іонів, які утворюються з молекул або кристалічних речовин. Уявлення про утворення іонів у розчинах електролітів утвердилося в хімії в першій половині XIX ст. завдяки працям англійського фізика і хіміка М. Фарадея. Процес розщеплення електролітів на іони у водних розчинах і розплавах називається електролітичною дисоціацією.
Розчини деяких речовин у воді не проводять електричний струм. Такі речовини називаються неелектролітами. Неелектролітами є багато органічних сполук, наприклад сахари, спирти.
Теорія електролітичної дисоціації для водних розчинів була сформульована шведським ученим С. Арреніусом у 1887 р. Розглянемо основні положення цієї теорії.
1. При розчиненні у воді молекули електролітів дисоціюють (розщеплюються) на позитивно і негативно заряджені іони. Іони можуть бути утворені з одного атома – прості іони (Na+, Cl-) і кількох атомів – складні іони ().
2. Дисоціація – оборотний процес. Як правило, він
не відбувається до кінця, а в системі встановлюється динамічна рівновага, тобто такий стан, при якому швидкість дисоціації дорівнює швидкості зворотного процесу - утворення вихідних молекул. Тому у рівняннях дисоціації замість знака „ дорівнює ” ставлять знак оборотності.
3. Іони у водному розчині перебувають у хаотичному безперервному русі. Якщо у розчин електроліту занурити електроди і прикласти до них електричну напругу, то іони набудуть направленого руху: позитивно заряджені іони переміщуватимуться у напрямі до катода (негативно зарядженого електрода), а негативно заряджені іони у напрямку анода (позитивно зарядженого електрода). Іони також одержали назви: позитивні іони – аніони, а негативні – катіони.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 492; Нарушение авторских прав?; Мы поможем в написании вашей работы!