
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Билет 19 1 страница. 1.СОЛІ - органічні речовини, утворені металом і кислотним залишком
В14
В13
Б12
В11
Б10
1.СОЛІ - о рганічні речовини, утворені металом і кислотним залишком. Бувають: звичайна(Ме+кис.залишок), кисла(зявляється Н), основна(зявляється ОН MgOHCl), подвійна(два метали і кисл.залишок KAl(SO4)2), комплексні (комплексні іони K4[Fe(CN)6]) взаємодіють з кислотами, основами, металами, солями. Назви середніх солей утворюються з двох слів: назви металу у називному відмінку та назви аніона кислоти, наприклад: СаSО4 – кальцій сульфат; КСl – калій хлор.
2. SO3, Властивості концентрованої і розведеної H2SO4.
H2SO4 - Безбарвна масляниста,дуже в'язка і гігроскопічна рідина. Сірчана кислота одна з найсильніших неорганічних кислот і є дуже їдкою та небезпечною. Ця кислота утворює два ряди солей: сульфати і гідрогенсульфати, в яких у порівнянні з сульфатною кислотою замінюються один або два аніони гідрогену на катіони металів. Сірчана кислота є однією з найважливіших технічних речовин у світі і лідирує за кількістю виробництва. Вона в основному використовується для виробництва добрив і інших неорганічних кислот. В основному використовуються водні розчини цієї кислоти. Добування: 1.випалювання в «киплячому шарі»(циклон, електрофільтр, сушильна башта, теплообмінник) 2.Контактний апарт, 3.Вбирна башта. Лакмус і метил оранж – рожевий. Реагує з солями, металами, оксидами. Концентрована звуглює орг..речовини. застосування: як проносне. При дії розведеної сульфатної кислоти на метали, які у електрохімічному ряді активності металів розташовані ліворуч водню, виділяється водень. Концентрована сірчана кислота має сильний окислювальний ефект і здатна реагувати, при нагріванні, навіть з благородними металами, такими як мідь, ртуть і срібло, хоча при цьому вона не взаємодіє з залізом. Тому для перевезення концентрованої сульфатної кислоти використовуються залізні цистерни. 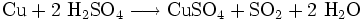
1.періодичний закон - властивості хімічних елементів, простих речовин, а також склад і властивості сполук перебувають у періодичній залежності від значень зарядів ядер атомів.
2. сульфати. Сульфа́ти — солі сірчаної кислоти — H2SO4.Сульфатна кислота утворює два ряди солей: нормальні солі, які називають сульфатами, і кислі, які називають гідрогенсульфатами. Сульфати у більшості добре розчинні. До малорозчинних належать сульфат кальцію CaSO4 і сульфат свинцю PbSO4. Нерозчинним у воді є сульфат барію BaSO4. Багато сульфатів широко застосовується у практиці, наприклад BaSO4, CaSO4 і CuSO4. Сульфати міді та заліза іноді називають купоросами.
1. Теорія Резерфорда: кожний електрон обертається навколо атомного ядра, причому сила притягання ядра зрівноважується відцентрованою силою, яка виникає при обертанні електрона. Теорія Бора: проминиста енергія виділяється і вбирається певними порціями – квантами.
2.азот і фосфор. У вільному стані фосфор буває в кількох алотропічних модифікаціях. Найбільше значення мають так звані білий і червоний фосфор. Білий фосфор являє собою безбарвну воскоподібну речовину з жовтуватим відтінком, через що його називають також жовтим фосфором. Білий фосфор — легкозаймиста речовина. Червоний фосфор являє собою порошкоподібну речовину червоно-бурого кольору, не отруйний і в сірковуглеці не розчиняється. При охолодженні пари фосфору переходять у білий фосфор. Чорний фосфор – речовина, схожа на графіт, має шарувату будову. Він масний на дотик, з металічним блиском, виявляє властивості напівпровідників. Реагую з киснем, неметалами, з багатьма металами, утворюючи фосфіди: 2P + 3Ca = Ca3P2. при дії на фосфід кальцію розведеної хлоридної кислоти утворюється фосфін PH3. Азот — газ без кольору, запаху, смаку. Азот не підтримує ні дихання, ні горіння. У воді розчиняється мало. Щоб розкласти молекулу азоту на атоми, треба витратити значну кількість енергії. Тому азот при звичайних умовах хімічно досить пасивний. При високих температурах, коли молекули N2 розкладаються і азот переходить в атомарний стан, він легко вступає в реакції з металами, утворюючи нітриди: 6Li + N2 = 2Li3N (нітрид літію) При високій температурі, високому тиску і наявності каталізатора нітроген сполучається з гідрогеном з утворенням амоніаку. при грозових розрядах: N2 + O2 = 2NO.
1. головне квантове число – це число, що позначає номер енергетичного рівня. Воно характеризує запас енергії електронів, які займають даний енергетичний рівень. Орбітальне квантове число – характеризує форму орбіта лі, електричної хмари і має значення (0,1,2,3). Магнітне квантове число – характеризує просторове розміщення орбіта лей, число його значень залежить від орбітального квантового числа і вказує на число орбіта лей. Азот — газ без кольору, запаху, смаку. Азот не підтримує ні дихання, ні горіння. У воді розчиняється мало. Щоб розкласти молекулу азоту на атоми, треба витратити значну кількість енергії. Тому азот при звичайних умовах хімічно досить пасивний. При високих температурах, коли молекули N2 розкладаються і азот переходить в атомарний стан, він легко вступає в реакції з металами, утворюючи нітриди: 6Li + N2 = 2Li3N (нітрид літію) При високій температурі, високому тиску і наявності каталізатора нітроген сполучається з гідрогеном з утворенням амоніаку. при грозових розрядах: N2 + O2 = 2NO.
2.Азот — газ без кольору, запаху, смаку. Азот не підтримує ні дихання, ні горіння. У воді розчиняється мало. Щоб розкласти молекулу азоту на атоми, треба витратити значну кількість енергії. Тому азот при звичайних умовах хімічно досить пасивний. При високих температурах, коли молекули N2 розкладаються і азот переходить в атомарний стан, він легко вступає в реакції з металами, утворюючи нітриди: 6Li + N2 = 2Li3N (нітрид літію) При високій температурі, високому тиску і наявності каталізатора нітроген сполучається з гідрогеном з утворенням амоніаку. при грозових розрядах: N2 + O2 = 2NO.
1Електро́нна конфігура́ція — формула розташування електронів на різних електронних оболонках атома хімічного елемента. Число електронів на оболонці дорівнює числу протонів у ядрі атома і визначається протонним числом елемента (порядковим номером). Аби зрозуміти, як побудована електронна оболонка атома, потрібно з'ясувати, як розподіляється електронна густина біля ядра, тобто визначити ділянку простору, де можуть перебувати електрони даного атома.Число електронів на оболонці дорівнює числу протонів у ядрі атома і визначається протонним числом елемента. Електрони в атомі розмішуються на різній відстані від ядра. Це пояснюється тим, що електрони мають різний запас енергії. Одні з них сильніше притягуються до ядра і розмішуються ближче до нього, вони міцніше зв'язані з ядром і їх важче вирвати з електронної оболонки. Інші — слабкіше притягуються і перебувають далі від ядра. Принцип Паулі:в атомі не може бути електронів з однаковим значенням усіх 4 квантових чисел. Правило Гунда:електрони розміщуються на однакових орбіталях таким чином,щоб сумарний спін був максимальним
2. Аміа́к, NH3 — неорганічна сполука, безбарвний газ із різким задушливим запахом, легший за повітря майже у два рази, добре розчинний у воді (при 0°С в 1 об'ємі води розчиняється 1200 об'ємів NH3, а при 20°С - 700 об'ємів). Використовують переважно для виробництва азотних добрив, вибухових речовин і азотної кислоти. Рідкий аміак використовується в холодильних установках. Водний розчин аміаку (нашатирний спирт) застосовується в медицині. Його зберігають і транспортують у рідкому стані в стальних балонах під тиском 6—7 атм. При нагріванні розчину аміак легко випаровується. Хімічні властивості. Молекули аміаку утворюються за допомогою ковалентних зв'язків.Однак зв'язки N—Н в молекулі аміаку полярні, оскільки електронна пара зміщена до атома азоту. Тому атом азоту має негативний заряд, а атом водню — позитивний. У хімічному відношенні аміак є відновником, а сам звичайно окиснюється до вільного азоту. Так, в атмосфері кисню аміак горить за реакцією:4NH3 + 3O2 = 2N2 + H2O. Амоніак також легко відновлює монооксид міді до металічної міді при високій температурі за реакцією: 3CuO + 2NH3 = 3Cu + N2 + 3H2O. В розчині аміаку в рівновазі одночасно існують молекули аміаку, води і гідроксиду амонію та іони амонію і гідроксилу. Гідроксид амонію є дуже нестійкою речовиною і може існувати лише в розчині. При нагріванні розчину рівновага зміщується вліво, і розчин розкладається на вихідні речовини. Цей розклад частково відбувається і при звичайній температурі, тому розчини аміаку завжди мають специфічний запах. При тривалому кип'ятінні розчину можна повністю видалити аміак. Розчин гідроксиду амонію забарвлює лакмус у синій колір. З кислотами розчин гідроксиду амонію утворює солі, наприклад:NH4OH + HCl = NH4Cl + H2O. Добування аміаку. В лабораторних умовах відбувається в дві стадії: 2NH4Cl + Ca(OH)2 = 2NH4OH + CaCl2. Потім:NH4OH = NH3↑ + H2O.. промисловий спосіб: N2+3H2=2NH3
Білет 17
Швидкість хімічної реакції
Швидкість хімічної реакції визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму.
Формула середньої швидкості хімічної реакції:
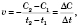
де  — середня швидкість хімічної реакції,
— середня швидкість хімічної реакції, 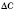 — зміна концентрації реагенту,
— зміна концентрації реагенту, 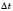 — час.
— час.
Чинники, що впливають на швидкість хімічної реакції
1) Природа реагуючих речовин.
2) Агрегатний стан реагуючих речовин.
3) Концентрація реагуючих речовин.
Основний закон хімічної кінетики — закон діючих мас для швидкості хімічних реакці й: швидкість хімічної реакції за сталої температури пропорційна добутку концентрацій реагуючих речовин.
Для реакції  :
:
 ,
,
де k — коефіцієнт;  і
і  — концентрації реагуючих речовин (моль/л).
— концентрації реагуючих речовин (моль/л).
4) Площа поверхні зіткнення реагуючих речовин.
Ця залежність справедлива для гетерогенних систем за участю твердих речовин.
5) Зміна температури.
Залежність швидкості реакції від температури описується правилом Вант-Гофф а: при підвищенні температури на кожні 10 °С швидкість більшості реакцій збільшується у 2—4 рази.
 ,
,
де 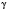 — температурний коефіцієнт.
— температурний коефіцієнт.
6) Для газів — тиск у системі.
7) Наявність каталізаторів.
Каталізатори — це речовини, що змінюють швидкість хімічної реакції. Каталізатор у процесі реакції не витрачається і до складу кінцевих продуктів не входить. Позитивний каталіз — прискорення реакції. Негативний каталіз, або інгібування, — уповільнення реакції.
Закон діючих мас встановлює співвідношення між масами реагуючих речовин в хімічних реакціях при рівновазі, а також залежність швидкості хімічної реакції від концентрації вихідних речовин.
2. Алотропія (від гр. ἄλλος, állos — інший і τρόπος, trópos — властивість) — явище, коли хімічний елемент існує у вигляді двох або кількох простих речовин. Так проста речовина кисень O2 і проста речовина озон O3 є алотропічними видозмінами елементу оксигену.
Вуглець, фосфор, сірка і інші елементи також утворюють алотропічні видозміни. Алотропічні видозміни, або модифікації, обумовлюються або різною кількістю атомів у молекулах, або різною кристалічною будовою твердих тіл, що складаються з атомів того самого хімічного елементу. Явищами алотропії пояснюється і той факт, що простих речовин відомо значно більше, ніж хімічних елементів. Відомо понад 400 простих речовин, а хімічних елементів — лише 118.
| Елемент | Форма |
| Вуглець |
|
| Фосфор: |
|
| Кисень: |
|
| Сірка: |
|
| Селен: |
|
Фосфор досить поширений елемент (0,08% маси земної кори). В природі він зустрічається винятково у зв'язаному стані. Найважливішими природними сполуками фосфору є мінерали фосфорит Са3(PO4)2 і апатит, який у своєму складі містить, крім Са3(PO4)2, СаP2 або CaCl2. Багаті родовища апатиту є на Кольському півострові, а також у південному Казахстані (гори Каратау), на Уралі, в Естонії, Ленінградській і Московській областях, в Україні і в інших місцях. Фосфор є також постійною складовою частиною живих організмів — рослин і тварин. Особливо значні його кількості містяться в кістках тварин (і людини) у вигляді фосфату кальцію Са3(PO4)2. Крім того, фосфор входить до складу нуклеінових кислот та білків.
Білет 18
Хімічна рівновага
Хімічні реакції, які за одних і тих самих умов можуть іти в протилежних напрямах, називаються оборотним и. У випадку, якщо за даних умов реагенти повністю перетворюються на продукти реакції, реакції називаються необоротним и.
Умови необоротності хімічних реакцій
1) Продукти, що утворюються, виводяться зі сфери реакції — випадають у вигляді осаду, виділяються у вигляді газу:


2) Утворюються малодисоціюючі сполуки, наприклад вода:

3) Виділяється велика кількість енергії:

Хімічна рівновага
Оборотні реакції не йдуть до кінця і закінчуються встановленням хімічної рівноваги — такого стану системи реагуючих речовин, за якого швидкості прямої та зворотної реакцій однакові.
Стан хімічної рівноваги можна змістити в той або інший бік зміною зовнішніх умов: температури, тиску, концентрації речовин, що беруть участь у реакції. Ці зміни визначаються принципом динамічної рівноваги— принципом Ле Шатель є: зовнішня дія на рівноважну систему зміщує рівновагу в напрямі ослаблення ефекту цієї дії.
Із принципу Ле Шательє випливає:
1) при збільшенні концентрації однієї з реагуючих речовин рівновага зміщується у бік витрачання цієї речовини, а при зменшенні концентрації — у бік її утворення;
2) зміна тиску зміщує рівновагу тільки в газових системах. Зі збільшенням тиску рівновага зміщується у бік зменшення об’єму (кількості речовини) газоподібних речовин, із зменшенням тиску — у бік збільшення об’єму (кількості речовини) газоподібних речовин. Якщо реакція проходить без зміни числа молекул (кількості речовини) газоподібних речовин, то тиск не впливає на стан рівноваги;
3) під час підвищення температури рівновага зміщується у бік перебігу ендотермічної реакції, під час зниження температури — екзотермічної реакції.
2. Кисневі сполуки фосфору. Фосфорна кислота та її солі.
Фocфop мaє дyжe виcoкy cпopiднeнicть дo Oкcигeнy. Cпoлyчaючиcь з киcнеь, фocфop утворює оксид фocфopy(III) P2О3 й oкcид фocфopy(V) P2О5. Під чac взaємoдiї фocфopy з лyгoм, кpiм фocфiнy, yтвopюютьcя гiпoфocфiти, coлi гiпoфocфiтнoї киcлoти H3PО2.
Ця киcлoтa oднoocнoвнa, дocить cильнa (KД = 10-1). Cтyпiнь oкиcнeння Фocфopy в мoлeкyлi H3PO2 низький (+1), caмa киcлoтa тa її coлi є дyжe aктивними вiднoвникaми. Гiпoфocфiти викopиcтoвyють як вiднoвники пiд чac xiмiчнoгo нiкeлювaння. Aнгiдpидy H3PO2 нe дoбyтo.
Oкcид фocфopy(III) P2О3, aбo aнгiдpид фocфiтнoї киcлoти, yтвopюєтьcя в paзi пoвiльнoгo oкиcнeння фocфopy. Цe бiлi кpиcтaли, щo плaвлятьcя зa тeмпepaтypи 23,8°C. Зa мoлeкyляpнoю мacoю P2О3 вiдпoвiдaє фopмyлi P4О6. Пiд чac взaємoдiї P2О3 з вoдoю yтвopюєтьcя фocфiтнa киcлoтa H3PO3, якa y чиcтомy виглядi є бeзбapвнoю кpиcтaлiчнoю peчoвинoю. У poзчинi H3PO3, диcoцiює як двoxocнoвнa киcлoтa cepeдньoї cили
(KД1 = 2*10-2, KД2 = 3 · 10-7).
Coлi H3PO3 нaзивaютьcя фocфiтaми. Бiльшicть фocфiтiв нe poзчиняєтьcя y вoдi, зa виняткoм фocфiтiв лyжниx мeтaлiв, aмoнiю i кaльцiю. P4О6, H3PO3 i фocфiти є oтpyйними peчoвинaми. Iнoдi киcлoтy H3PO3 нaзивaють opтoфocфiтнoю, ocкiльки вiдoмi coлi мeтaфocфiтнoї киcлoти HPO2.
Bci oкcигeнoвмicнi cпoлyки фocфopy(III) мaють cильнi вiднoвнi влacтивocтi. Пpoтe в киcлoмy poзчинi aктивнi мeтaли вiднoвлюють H3PO3 дo PH3. Пiд чac нaгpiвaння H3PO3 диcпpoпopцioнyє:
Oкcид фocфopy(V) P2О5, aбo aнгiдpид фocфaтнoї киcлoти — цe бiлa cнiгoпoдiбнa мaca, щo yтвopюєтьcя пiд чac гopiння фocфopy нa пoвiтpi aбo y киcнi. Moлeкyляpнa мaca oкcидy фocфopy(V) вiдпoвiдaє фopмyлi P4О10. Oкcид фocфopy(V) cильний вoдoвiдбиpний зaciб, пpитягyючи вoлoгy, вiн пepeтвopюєтьcя нa poзпливчacтy мacy мeтaфocфaтнoї киcлoти.
Фocфaтнi киcлoти. 3 ycix фocфaтниx киcлoт нaйбiльшe знaчeння мaє opтофocфaтнa, якy чacтo нaзивaють пpocто фocфaтнoю. Цe твepдa peчoвинa з тeмпepaтypoю плaвлeння 42°C. Poзплaвлeнa H3PО4 тa її кoнцeнтpoвaнi poзчини (~80 %) мaють вeликy в'язкicть, щo зyмoвлeнo нaявнicтю мiжмoлeкyляpниx вoднeвиx зв'язкiв P - О... H - О - P тa P - О... H - OH.
Beликi кiлькocтi H3PО4 дoбyвaють poзчинeнням oкcидy фocфopy(V) y гapячiй вoдi (peaкцiя йдe дyжe eнepгiйнo), oкиcнeнням фocфopy нiтpaтнoю киcлoтою тa пiд дiєю cyльфaтнoї киcлoти нa opтoфocфaт кaльцiю:
Opтoфocфaтнa киcлoтa мoжe викpиcтaлiзyвaтиcя y виглядi бeзбapвниx рoмбiчниx пpизм. Бyдoвy мoлeкyли H3PО4 зoбpaжeнo нa мал.
H3PO4 дyжe дoбpe poзчиняєтьcя y вoдi, цe киcлoтa cepeдньoї cили (КД1 =7*10-3; КД2 =6·10-8; КД3 =10-11).
Ha вiдмiнy вiд мeтaфocфaтнoї киcлoти, H3PО4 нe oтpyйнa, yтвopює oднo- двo- i тpизaмiщeнi coлi. Cepeднi coлi цiєї киcлoти нaзивaютьcя фocфaтaми, киcлi — гiдpoгeнфocфaтaми i дигiдpoгeнфocфaтaми. Дигiдpoгeнфocфaти дoбpe poзчиняютьcя y вoдi, a бiльшicть фocфaтiв i гiдpoгeнфocфaтiв — пoгaнo, зa виняткoм coлeй лyжниx мeтaлiв тa aмoнiю.
Пiд чac нaгpiвaння дo 225°C opтoфocфaтнa киcлoтa чacткoвo втpaчaє вoдy i пepexoдить y дифocфaтнy киcлoтy:
Фocфaти y вoдниx poзчинax гiдpoлiзyють. Poзчини фocфaтiв лyжниx мeтaлiв мaють cильнoлyжнy peaкцiю, poзчини гiдpoгeнфocфaтiв лyжниx мeтaлiв — cлaбкoлyжнy, poзчини дигiдpoгeнфocфaтiв — cлaбкoкиcлy.
Дифocфaтнa киcлoтa — цe бeзбapвнi кpиcтaли з тeмпepaтypoю плaвлeння 61°C. H4P2О7 дoбpe poзчиняєтьcя y вoдi, вoнa cильнiшa, нiж H3PО4 (КД1 = 3 *10-2; КД2 = 4*10-3; КД3 = 2 * 10-7; КД4 = 5*10-10). Для H4P2О7 вiдoмi киcлi (Na2H2P2О7) i cepeднi (Na4Р2О7) coлi. Kиcлi coлi дифocфaтнoї киcлoти poзчиняютьcя y вoдi, cepeднi — мaлopoзчиннi.
Білет № 19
1.Охарактеризуйте розчини. Класифікуйте розчини за різними ознаками. Гідратна теорія розчинів.
Розчин-однорідна система з 2 або кількох компонентів та продуктів їх взаємодії.
Класифікація розчинів за розмірами частинок речовин:
1.істинні(справжні)- добре розчинені
2.зависі:
*суспензії(будь-яка тверда речовина)
*емульсії(молоко, олія у воді)
3.колоїдні(може бути осад)
Класифікація розчинів за агрегатним станом розчинника і розчиненої речовини:
1.рідкі
2.тверді
3.газоподібні
Рідкі класифікують за такими ознаками:
1.за типом розчинника:
*водні
*неводні
2.за типом розчинених речовин:
*електроліти
*неелектроліти
3.за типом розчинених речовин:
*кислоти
*основи
*солі
4.за концентрацією розчинених речовин:
*розбавлені
*концентровані
5.за досягненням розчинності:
*насичені
*ненасичені
Гідратна теорія розчинів(Мендєлеєв, Каблуков,Курнаков), вважали, що між розчиненою речовиною і молекулами розчинника відбувається хімічна взаємодія-утворюються гідрати(якщо розчинник вода і сольвати, і якщо розчинник не водний).
2.Охарактеризуйте типи хімічних зв’язків:ковалентний, йонний, металевий, водневий.
Ковалентний зв'язок –зв'язок, утворений за рахунок спільних електронних пар.
а)ковалентний неполярний(зв'язок утворений за рахунок спільних електронних пар рівновіддалених від обох атомів)
б)ковалентний полярний(хімічний зв'язок за допомогою спільних електронних пар, які зміщені в бік більш-електронегативного елемента), утворюються між двома неметалами.
Йонний хімічний зв'язок — це тип зв'язку, при якому електрони переходять із одного атома до іншого, й основний вклад в притягання вноситьсяелектростатичною взаємодією.
Утворюється між атомами або групами атомів зі значною різницею в електронегативностях.
Характерний для сполук металів з найтиповішими неметалами.
Кристалічні тверді тіла, утворені завдяки йонному зв'язку, називаються іонними кристалами. Прикладом такого кристалу є кам'яна сіль NaCl. До йонних кристалів належать також численні оксиди (MgO).
Металічний зв'язок
В масі металу між атомами утворюється металічний зв'язок, ознакою якого є спільність всіх валентних електронів для всіх атомів. Завдяки такому зв'язку метали добре проводять електричний струм і тепло. є пластичними, легко куються і прокатуються.
Водне́вий зв'язо́к — різновид хімічного зв'язку, що реалізується за донорно-акцепторним механізмом між двома ковалентно зв'язаними атомами з великим значенням електронегативності (О, N, F) за посередництвом атома Гідрогену Н.
Водневий зв'язок є прикладом трицентрового чотириелектронного зв'язку.
Завдяки водневому зв'язку вода (головний розчинник у неорганічній хімії та біохімії) має високу температуру плавлення і кипіння. Водневий зв'язок з'єднує подвійну спіраль ДНК (носія генетичноїінформації), а також відповідає за формування вторинної і третинної структури білків.
Білет №20
1.Насичений розч. У певній кількості води при даній температурі може розчинятися лише певна кількість речовини, а надлишок її залишається нерозчинним. Розчин, у якому взята речовина при даній температурі більше не розчиняється, називається насиченим. При виготовленні насиченого розчину до розчинника додають звичайно таку кількість розчинюваної речовини, щоб частина її залишалася нерозчинною, скільки б розчин не розмішували і не збовтували.
Пересичений розчинв яких розчинюваної речовини в розчиненому стані більше, ніж потрібно для одержання насиченого розчину. Але пересичені розчини зустрічаються порівняно рідко, і їх утворюють лише деякі речовини. Пересичені розчини дуже нестійкі і досить легко розкладаються з виділенням надлишку розчиненої речовини і утворенням насиченого розчину.
ненасиченим розчином Якщо розчин містить менше розчиненої речовини, ніж потрібно для насичення, то такий розчин називається ненасиченим розчином. У ненасичених розчинах межа насичення не досягнута, але, змінюючи, наприклад, температуру розчину, можна її досягти.
Розчинність залежить від природи розчинюваної речовини і розчинника, температури й тиску. Деякі речовини необмежено розчиняються у воді. Це сульфатна, нітратна, оцтова кислоти, гідроген пероксид, винний спирт.
2. Бісмут (Bi) — хімічний елемент з атомним номером 83 та його проста речовина — крихкий метал сріблястого кольору Бісмут, є тривалентним металом. Бісмут зустрічається у природі у вільному стані, хоча для видобутку значення мають мінерали що утворені його сульфідами чи оксидами. Металічний бісмут на 86% легший за свинець, крихкий, сріблястого кольору, але із рожевим відливом, що обумовлено плівкою оксиду на поверхні. Бісмут є найсильнішим діамагнетиком з металів, та його теплопровідність також одна з найнижчих, окрім ртуті.В періодичній системі елементів Бісмут завершує ряд елементів, що мають стабільні ізотопи. Хоча сам Бісмут є трохи радіоактивним Сполуки Бісмуту застосовують у косметиці, медицині та інших галузях. Бісмут має незвичайно низьку токсичність для важкого металу.
Хімічний символ Арсену – Аs. Це лементи VА групи. На зовнішньому енергетичному рівні 5ē: 4s24p3.
Атомний радіус більший ніж у Нітрогену і Фосфору, тому він має менше значення електронегативності і менші окислювальні властивості. В Арсену більше виражені металічні властивості, ніж у Нітрогену і Фосфору. У сполуках проявляє ступні окислення: +5, +3, -3.
Стибій (Sb), інші назви - хімічний елемент із атомним номером 51, сріблясто-білий крихкий напівметал, який застосовують у металургійній, ґумовій, фармацевтичній промисловості, піротехниці.
Арсен при надходженні в організм в надмірних кількостях арсен призводить до мутацій ДНК людини. Смертельна доза при прийомі всередину 0,05—0,2 г.Симптоми: блювота, металевий присмак у роті, сильний біль у животі, блювотні маси зеленого кольору, рідкий кал, різке зневоднення організму, судоми, втрата свідомості. Невідкладна допомога: промивання шлунку, клізми, унітиол (5 мл 5% розчину) в/в 8 разів на добу; в/в крапельно тетацин-кальцій (30 мл 10% розчину) у 500 мл 5% розчину глюкози; вітаміни С, В1, В6, В12. В/в хлорид кальцію (10 мл 10% розчину); під шкіру ізотонічний розчин хлориду натрію та 5% розчин глюкози до 3 л/добу. При болю у животі - атропін (1 мл 0,1% розчину). Серцево-судинні засоби.
№ 21
Теорія електролітичної дисоціації
Більшість хімічних реакцій, які використовуються у якісному аналізі, протікають у водних розчинах. Якщо речовина розчиняється у воді чи іншому розчиннику, то утворюється однорідний гомогенний розчин. Розчини не можна розглядати як прості механічні суміші. Процес розчинення завжди супроводжується виділенням чи поглинанням теплоти.
Водні розчини деяких речовин є провідниками електричного струму. Ці речовини належать до електролітів. Електролітами є кислоти, солі та луги. Багато речовин виявляють властивості електролітів у розплавленому стані. Електрична провідність розчинів і розплавів електролітів зумовлена наявністю у розчині негативно та позитивно заряджених іонів, які утворюються з молекул або кристалічних речовин. Уявлення про утворення іонів у розчинах електролітів утвердилося в хімії в першій половині XIX ст. завдяки працям англійського фізика і хіміка М. Фарадея. Процес розщеплення електролітів на іони у водних розчинах і розплавах називається електролітичною дисоціацією.
Розчини деяких речовин у воді не проводять електричний струм. Такі речовини називаються неелектролітами. Неелектролітами є багато органічних сполук, наприклад сахари, спирти.
|
|
Дата добавления: 2015-05-23; Просмотров: 511; Нарушение авторских прав?; Мы поможем в написании вашей работы!