
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Будова атомів
Атом хімічного елемента складається з позитивно зарядженого ядра та електронів із зарядом “-1”, які рухаються навколо ядра і утворюють електронну оболонку атома. У складі ядра знаходяться протони із зарядом “+1” та електронейтральні частинки – нейтрони. Протони та нейтрони мають загальну назву – нуклони. Заряд ядра атома обумовлений наявністю протонів у складі ядра.
Протонне число (порядковий номер) хімічного елемента чисельно дорівнює числу протонів, що містяться у складі ядра його атомів. Наприклад, протонне число натрію 11. Отже, в ядрі атомів натрію знаходяться 11 протонів.
Нуклонне число хімічного елемента дорівнює числу нуклонів, тобто сумарному числу протонів та нейтронів у складі ядра атома. Нуклонне число хімічного елемента – це найближче до його атомної маси ціле число. Так, атомна маса натрію Ar(Na)=22,7, а нуклонне число становить 23. Отже, ядро атома натрію складається з 23 нуклонів, а саме: з 11 протонів та 12 нейтронів.
Оскільки атом електронейтральний, то число електронів, які утворюють його електронну оболонку, дорівнює числу протонів у складі ядра атома. Так, в атомі натрію містяться 11 електронів.
Ядро атома не бере участь в хімічних реакціях. Це означає, що хімічні властивості елементів залежать лише від електронної будови їх атомів, тобто від структури їх електронних оболонок.
Сучасна теорія електронної будови атомів ґрунтується на уявленні про двоїсту, корпускулярно-хвильову природу мікрочастинок, в тому числі і електронів: електрон є матеріальною частинкою з певною масою та зарядом, але рух електронів має хвильову природу. Саме тому стан електронів в атомі вивчає не класична механіка, яка є механікою макрооб’єктів, а квантова механіка. Квантова механіка – це механіка мікрочастинок, яка враховує їх двоїсту природу. Основою квантової механіки є рівняння Шредінгера, яке в квантовій механіці відіграє таку ж роль, як закони Ньютона в класичній механіці. Рішенням рівняння Шредінгера є хвильова функція Y, як функція просторових координат х, у, z. Але фізичний зміст має не сама хвильова функція, а квадрат її модуля çYç2, який характеризує ймовірність перебування електрона в певній точці простору, а çYç2·dv – в елементі простору dv навколо ядра атома. Частина простору навколо ядра атома, де ймовірність перебування електрона є найбільшою (»90%), називається електронною хмарою. Таким чином, квантова механіка вказує не на точне знаходження електрона в атомі, а на ймовірність його перебування у просторі навколо ядра атома, тобто замінює поняття “траєкторія руху електрона” на поняття “електронна хмара”.
Рішення рівняння Шредінгера, тобто хвильова функція Y містить безрозмірні цілочисельні параметри n, ℓ, mℓ – квантові числа.
Хвильова функція з конкретними значеннями квантових чисел Y n,ℓ,mℓ називається атомною орбіталлю АО.
Головне квантове число п характеризує повний запас енергії електрона на певному енергетичному рівні. Головне квантове число набуває значень від одиниці до нескінченості: n = 1,2,3…∞. Кожному значенню n відповідає певний запас енергії електрона Е. Із збільшенням значення n збільшується запас енергії електрона та відстань електрона від ядра, послаблюється зв’язок електрона з ядром. Якщо n=1, то це означає, що електрон знаходиться на першому енергетичному рівні; якщо n=2, то це означає, що електрон знаходиться на другому енергетичному рівні; n=3, то – на третьому рівні тощо:
n = 1, 2, 3, 4, …….. ¥
Е1 < E2 < E3 < E4
І ІІ ІІІ ІV
енергетичні рівні
Орбітальне квантове число ℓ характеризує енергію електрона на певному енергетичному підрівні у межах одного енергетичного рівня та форму електронної хмари. Орбітальне квантове число набуває значень від 0 через кожну одиницю до (n-1), але максимальне значення ℓ не перевищує 3 для заповнених електронами енергетичних рівнів атомів відомих хімічних елементів: ℓ = 0 ¸ (n-1); ℓ max ≤ 3.
Із збільшенням значення ℓ, при однаковому значенні n, збільшується енергія електрона у межах енергетичного рівня, тобто енергетичний рівень розщеплюється на підрівні.
Винятком є перший енергетичний рівень, для якого n=1, а ℓ =0. Це свідчить про те, що перший енергетичний рівень складається тільки з одного підрівня, який називається 1s-підрівнем. Число перед буквою вказує на те, що підрівень належить першому енергетичному рівню.
Якщо n=2, то ℓ =0 та 1. Орбітальне квантове число набуває двох значень, що свідчить про те, що другий енергетичний рівень розщеплюється на два підрівні: 2s- підрівень (ℓ =0) та 2р-підрівень (ℓ =1).
Якщо n=3, то ℓ набуває трьох значень: 0,1,2. Отже, третій енергетичний рівень розщеплюється на три підрівні: 3s- підрівень (ℓ =0), 3р-підрівень (ℓ =1) та 3d-підрівень (ℓ =2).
Четвертий енергетичний рівень (n=4) та всі подальші енергетичні рівні мають чотири підрівні: s-підрівень (ℓ =0), р-підрівень (ℓ =1), d-підрівень (ℓ =2) та f-підрівень (ℓ =3).
Отже, енергія електрона в атомі залежить від значення n і меншою мірою від значення ℓ.
Електрони, які перебувають на s-підрівні, називаються s-електронами, а на р-, d-, та f-підрівнях – відповідно р-, d-, та f-електронами. Частина простору, де ймовірність перебування s-електронів найбільша, тобто s-електронна хмара має форму кулі; р-електронна хмара має форму гантелі або об’ємної вісімки.
Магнітне квантове число m ℓ характеризує можливі орієнтації електронної хмари певної форми у просторі. Магнітне квантове число набуває значень від – ℓ через кожну одиницю до + ℓ:
m ℓ = - ℓ …0…+ ℓ
Якщо ℓ =0 (s-підрівень), то m ℓ теж дорівнює 0. Одному значеню m ℓ відповідає один спосіб орієнтації s-електронної хмари у просторі.

Наведений набір квантових чисел: будь-яке значення n, ℓ =0 та m ℓ =0 – вказує на те, що s-підрівень будь-якого енергетичного рівня містить тільки одну атомну орбіталь, яка називається s-атомною орбіталлю (s-АО).
Якщо ℓ =1 (р-підрівень), то m ℓ = -1, 0,+1. Три значення m ℓ свідчать про три способи орієнтації р-електронної хмари у просторі, а саме – вздовж осей x, y, z:
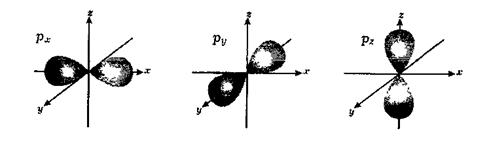
Таким чином, р-підрівень складається з трьох атомних орбіталей, які позначаються так: рх-, ру-, рz-АО.
Якщо ℓ =2 (d-підрівень), m ℓ = -2, -1, 0, +1, +2. Отже, d-підрівень складається з п‘яти d-атомних орбіталей, а f-підрівень (ℓ =3, mℓ= -3, -2, -1, 0, +1, +2, +3) – з сьоми f-атомних орбіталей.
Енергія електрона не залежить від способу орієнтації його електронної хмари у просторі, отже, електрони, що розміщені на атомних орбіталях одного і того ж підрівня, мають однакову енергію.
Значення трьох квантових чисел є повною характеристикою атомної орбіталі.
Але для характеристики стану електронів в атомі недостатньо значень трьох квантових чисел. Особливості атомних спектрів можна пояснити, якщо припустити наявність у електронів власного моменту кількості руху. Напрямок у просторі вектора власного моменту кількості руху електрона характеризується спіновим квантовим числом ms, яке набуває таких значень: +½, -½. Два значення ms вказують на два взаємно протилежні напрямки цього вектора у просторі, які позначають стрілками:
ms= + ½; ↑ ms= - ½. ↓
Значення чотирьох квантових чисел n,ℓ,mℓ,ms повністю характеризують квантовий стан електрона в атомі.
Хімічні властивості елементів залежать від структури електронної оболонки їх атомів, тобто від розподілу електронів по атомних орбіталях енергетичних рівнів та підрівнів, який відбувається за трьома правилами: за принципом Паулі, за правилом Хунда та правилом Клечковського.
Принцип Паулі. ”В атомі не можуть перебувати навіть два електрони з однаковим набором квантових чисел”.
Приклад. Охарактеризуйте квантовий стан електронів, які знаходяться на 5s-атомній орбіталі.
Розв’язання. Оскільки електрони розміщені на п’ятому енергетичному рівні, то n=5. Для s – підрівня ℓ=0 та mℓ=0. Спінове квантове число електронів становить лише +½ або -½. Значення квантових чисел для двох 5s-електронів наведені в таблиці:
| Електрон | n | ℓ | mℓ | ms |
| Перший | +½ | |||
| Другий | -½ |
Третій електрон мав би такий же набір квантових чисел, як і один з наведених в таблиці. Отже, за принципом Паулі на одній атомній орбіталі не може перебувати більше двох електронів. Якщо на орбіталі знаходиться один електрон, то він називається неспареним, а якщо два, то це – спарені електрони з антипаралельними спінами, тобто із значеннями спінового квантового числа +½ та –½.
Принцип Паулі обмежує число електронів на енергетичних підрівнях та рівнях: максимальне число електронів на першому енергетичному рівні становить два (1s2), на другому – вісім (2s22р6), на третьому – 18 (3s23p63d10), на четвертому (і на подальших) – 32 (4s24p64d104f14).
Правило Хунда визначає порядок розміщення електронів на атомних орбіталях в межах одного підрівня:
”Атомні орбіталі одного і того ж підрівня заповнюються електронами так, щоб модуль суми спінових квантових чисел був найбільшим”. Винятком є лише s-підрівень, на якому містяться не більше двох електронів з антипаралельними спінами: s↑↓.
Приклад. Вкажіть, який спосіб розміщення трьох електронів на р-підрівні є вірним:
а) рх↑ру↑рz↓; б) рх↑↓ру↑рz; в) рх↑ру↑рz↑
Розв’язання. Розрахуємо модуль суми спінових квантових чисел у кожному випадку:
а)  , б)
, б)  в)
в) 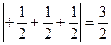 .
.
Отже, електрони розміщуються на р-підрівні за варіантом в), для якого модуль суми спінових квантових чисел є найбільшим.
Правило Клечковського визначає порядок заповнення електронами атомних орбіталей різних підрівнів і є відображенням принципа найменшої енергії, за яким електрон в атомі займає атомну орбіталь того підрівня, де його енергія буде найнижчою. Оскільки енергію електрона в атомі характеризують головне та орбітальне квантові числа, то сума їх значень дозволяє порівнювати енергію електрона на тому чи іншому підрівні: чим менша сума (n+ℓ), тим нижча енергія електрона на підрівні.
Правило Клечковського складається з двох частин:
1) атомні орбіталі різних підрівнів заповнюються електронами у порядку збільшення суми значень головного та орбітального квантових чисел (n+ℓ),
2) якщо сума (n+ℓ) для різних підрівнів однакова, то спочатку заповнюються електронами атомні орбіталі підрівня з меншим значенням n. Це пояснюється тим, що енергія електрона більшою мірою залежить від значення n, ніж від значення ℓ.
Розрахуємо суму (n+ℓ) для деяких підрівнів в атомі та вкажемо стрілкою послідовність їх заповнення електронами:
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p
n+ℓ 



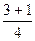





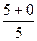


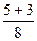
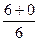
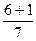
1s®2s®2p®3s®3p®4s®3d®4p®5s®4d®5p®6s®4f®5d®6p
Отже, енергія електрона на 4s-підрівні нижча за енергію електрона на 3d-підрівні. Тому, не зважаючи на те, що третій енергетичний рівень складається з трьох підрівнів, після заповнення 3s- та 3p-підрівнів наступним заповнюється електронами не 3d-, а 4s-підрівень. Такий же порядок заповнення підрівнів електронами відбувається і на інших енергетичних рівнях.
Висновки:
1. Перший енергетичний рівень має тільки один підрівень (1s-підрівень). Другий енергетичний рівень розщеплюється на два підрівні (2s- та 2p-підрівні), третій – на три підрівні (3s-, 3p- та 3d-підрівні), четвертий – на чотири підрівні (4s-, 4p-, 4d- та 4f-підрівні). На всіх подальших енергетичних рівнях атомів відомих хімічних елементів електрони заповнюють теж чотири підрівні.
2. s-Підрівень складається з однієї атомної орбіталі (s-AO), p-підрівень – з трьох атомних орбіталей (px–, py–, pz– AO), d-підрівень – з п‘яти d- атомних орбіталей, а f-підрівень – з сьоми f-атомних отбіталей.
3. Принцип Паулі обмежує число електронів на кожному енергетичному рівні: максимальне число електронів на першому енергетичному рівні становить два (1s2), на другому – вісім (2s22p6), на третьому – вісімнадцять (3s23p63d10), на четвертому (та подальших рівнях) – тридцять два (4s24p64d104f14).
4. Правило Хунда визначає порядок заповнення електронами атомних орбіталей в межах одного p-, d- та f-підрівня.
5. Правило Клечковського визначає порядок заповнення електронами атомних орбіталей різних підрівнів.
Розміщення електронів в атомі на атомних орбіталях енергетичних рівнів та підрівнів зображують у вигляді електронної конфігурації (електронної формули).
|
|
Дата добавления: 2015-05-23; Просмотров: 994; Нарушение авторских прав?; Мы поможем в написании вашей работы!