
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічна рівновага
Хімічні реакції можна поділити на необоротні та оборотні.
Необоротні реакції відбуваються тільки в одному напрямку: до повного перетворення хоча б однієї з вихідних речовин у продукти реакції.
У рівняннях необоротних реакцій між лівою та правою частинами ставиться знак рівності.
Прикладом необоротної реакції є взаємодія магнію з розчином сульфатної кислоти:
Mg + H2SO4 = MgSO4 + H2
Водень видаляється зі сфери реакції і зворотна реакція стає неможливою. Реакція відбувається до повного розчинення магнію.
До необоротних також належать реакції, енергія Гіббса яких зменшується за будь-яких температур (DG<0), тобто, якщо реакція відбувається з виділенням енергії (DН<0) і збільшенням ентропії (DS>0).
Наприклад, реакція за рівнянням:
2KClO3 (т) = 2KCl (т) + 3O2 (г), ΔH< 0
необоротна, тому що є екзотермічною (ΔH<0) і супроводжується зростанням ентропії (DS>0), оскільки кінцевий стан системи є більш невпорядкованим, ніж початковий. Зворотна реакція неможлива, оскільки її енергія Гіббса має збільшуватись (DG>0).
Оборотні реакції відбуваються одночасно у двох взаємно протилежних напрямках. Тому вони не доходять до кінця: жодний з учасників реакції не витрачається повністю. У рівнянні оборотної реакції між лівою та правою частинами ставляться дві стрілки, напрямлені у протилежні боки.
У загальному вигляді схема оборотної реакції має такий вигляд:
 аА + bB
аА + bB  cC + dD
cC + dD

вихідні речовини продукти реакції
Реакція, яка відбувається зліва направо (®), називається прямою, а справа наліво () – зворотною.
Якщо реакція гомогенна, де всі речовини є газуватими або знаходяться у розчині, то швидкість прямої та зворотної реакцій відображають такі кінетичні рівняння:
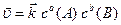 , (6.12)
, (6.12)
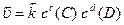 (6.13)
(6.13)
Спочатку при змішуванні вихідних речовин швидкість прямої реакції найвища, а швидкість зворотної реакції дорівнює 0. З часом вихідні речовини перетворюються у продукти реакції, їх концентрація зменшується і відповідно зменшується і швидкість прямої реакції. Одночасно збільшується концентрація продуктів реакції, що призводить до зростання швидкості зворотної реакції. Коли швидкості прямої та зворотної реакцій стають однаковими (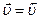 ), наступає хімічна рівновага.
), наступає хімічна рівновага.
 На малюнку показано, як змінюються швидкості прямої та зворотної реакцій з часом:
На малюнку показано, як змінюються швидкості прямої та зворотної реакцій з часом:

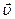


Хімічна рівновага є динамічною, тобто пряма та зворотна реакції не припиняються, але відбуваються з однаковими швидкостями. Тому концентрації всіх речовин – і вихідних, і продуктів реакції – залишаються з часом незмінними, але відрізняються від початкових. Концентрації речовин у стані хімічної рівноваги називаються рівноважними і позначаються формулами речовин, взятими у квадратні дужки: [А], [В], [С], [D].
У стані рівноваги ліві частини кінетичних рівнянь прямої та зворотної реакцій (6.11), (6.12) однакові, тому їх праві частини також дорівнюють одна одній:
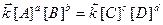
Звідки:
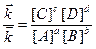
Відношення констант швидкості прямої та зворотної реакцій є величиною сталою, називається константою рівноваги і позначається буквою К:
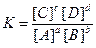 (6.14)
(6.14)
Константа рівноваги, як і константа швидкості реакції, залежить від температури та природи учасників реакції, але не залежить від їх концентрації.
Концентрації газуватих речовин можна замінити рівноважним парціальним тиском цих компонентів газової суміші:
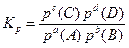 (6.15)
(6.15)
У виразі константи рівноваги гетерогенних реакцій, як і в кінетичних рівняннях таких реакцій, вказують концентрації лише газуватих або розчинених речовин.
Прикладом гетерогенних реакцій є реакції термічної дисоціації оксидів (наприклад, метал оксидів) на прості речовини, тобто реакції розкладу оксидів на прості речовини за нагрівання:
2MexOy (т)  2xMe (т) + yO2 (г), (6.16)
2xMe (т) + yO2 (г), (6.16)
Через те, що ці оборотні реакції відбуваються на поверхні поділу між твердою та газуватою фазами, константа їх рівноваги визначається лише тиском кисню:
KT=py(O2), (6.17)
або у логарифмічному вигляді:
lgKT = ylgp(O2), (6.18)
Рівноважний тиск кисню, який утворюється в замкненій системі внаслідок термічної дисоціації оксиду металу називається тиск дисоціації оксиду.
З виразу (6.18) тиск дисоціації оксиду дорівнює:
 ;
; 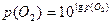 (6.19)
(6.19)
Порівнюючи тиск дисоціації різних оксидів, можна зробитти висновок, який з оксидів є більш стійким: чим менший тиск дисоціації оксиду, тим стійкішим є оксид.
Константа рівноваги реакцій пов’язана зі зміною енергії Гіббса за певної температури Т таким рівнянням:
DGТ = -RTlnKТ, (6.20)
З цього рівняння можна зробити висновок, що більшим від’ємним значенням DGТ реакції (DGТ<<0) відповідають великі значення константи рівноваги (К>>1). Це вказує на присутність в системі у стані рівноваги надлишку продуктів реакції порівняно з вихідними речовинами.
Якщо підставити в вираз (6.20) значення газової сталої (R=8,31·10-3 кДж/(моль·К)) та перейти до десяткового логарифму, одержуємо:
DGТ = - 19,1·10-3 TlgKТ, (6.21)
Цей вираз дає можливість визначити величину константи рівноваги реакцій:
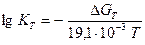 ;
; 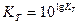 , (6.22)
, (6.22)
де за умови, що DНТ=DН0 і DSТ=DS0, зміна енергії Гіббса реакцій за температури Т дорівнює:
DGТ = DН0 – ТDS0, (6.23)
Для реакцій за рівнянням (6.16) тиск дисоціації оксидів дорівнює:
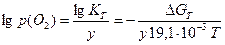 ,
, 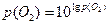 (6.24)
(6.24)
Ознаки хімічної рівноваги:
1. Будь-яка реакція відбувається у напрямку зменшення енергії Гіббса. У стані рівноваги енергія Гіббса системи набуває мінімального значення і перестає змінюватись (DG=0).
2. Стан рівноваги не залежить від шляху його досягнення, тобто від того, які речовини взаємодіють між собою – вихідні чи продукти реакції.
3. Стан рівноваги за сталих умов з часом залишається незмінним.
4. Хімічна рівновага є рухомою: за зміною умов рівноваги (концентрації, тиску, температури) швидкості прямої та зворотної реакцій стають неоднаковими (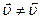 ), тобто стан рівноваги порушується. З часом встановлюється новий стан рівноваги. Перехід системи з одного стану рівноваги в інший називається зміщенням хімічної рівноваги: якщо внаслідок зміни зовнішніх умов швидкість прямої реакції стає більше швидкості зворотної реакції (
), тобто стан рівноваги порушується. З часом встановлюється новий стан рівноваги. Перехід системи з одного стану рівноваги в інший називається зміщенням хімічної рівноваги: якщо внаслідок зміни зовнішніх умов швидкість прямої реакції стає більше швидкості зворотної реакції (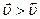 ), то рівновага зміщується у напрямку прямої реакції, а якщо
), то рівновага зміщується у напрямку прямої реакції, а якщо 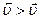 – то у напрямку зворотної реакції.
– то у напрямку зворотної реакції.
Напрямок зміщення рівноваги зі зміною концентрації учасників оборотної реакції, тиску та температури визначається за принципом Ле Шательє: “Зміна умов зміщує рівновагу у напрямку реакції, яка протидіє цій зміні”.
Зміна концентрації газуватих речовин або розчинених у розчині речовин.
Зі збільшенням концентрації будь-якого учасника реакції рівновага зміщується у напрямку витрати цієї речовини, внаслідок чого її концентрація зменшується:
– зі збільшенням концентрації вихідних речовин рівновага зміщується у напрямку прямої реакції;
– зі збільшенням концентрації продуктів реакції рівновага зміщується у напрямку зворотної реакції.
Якщо концентрація будь-якого учасника реакції зменшується, то рівновага зміщується у напрямку утворення цієї речовини:
– зі зменшенням концентрації вихідних речовин рівновага зміщується у напрямку зворотної реакції;
– зі зменшенням концентрації продуктів реакції рівновага зміщується у напрямку прямої реакції.
Зміна тиску зумовлює зміщення рівноваги, якщо в оборотній реакції приймають участь газуваті речовини.
Підвищення тиску (шляхом зменшення об’єму системи) зміщує рівновагу у напрямку утворення меншої кількості газуватих речовин, що призводить до зниження тиску.
І, навпаки, зниження тиску (шляхом збільшення об’єму системи) зміщує рівновагу у напрямку утворення більшої кількості газуватих речовин. Тиск при цьому збільшується.
Якщо кількість газуватих вихідних речовин дорівнює кількості газуватих продуктів реакції, то зміна тиску не спричинить зміщення хімічної рівноваги.
Зміна температури.
Підвищення температури зміщує рівновагу у напрямку ендотермічної реакції, яка відбувається з поглинанням енергії (DН>0) і супроводжується зниженням температури.
Зниження температури зміщує рівновагу у напрямку екзотермічної реакції, яка відбувається з виділенням енергії (DН<0) і супроводжується підвищенням температури.
Залежність константи рівноваги від температури визначається рівнянням (6.20), (6.23):
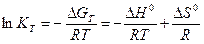 . (6.25)
. (6.25)
Якщо пряма реакція екзотермічна (DН0<0), то за підвищення температури константа рівноваги зменшується, тобто рівновага зміщується у напрямку зворотної реакції.
Якщо пряма реакція ендотермічна (DН0>0), то за підвищення температури константа рівноваги збільшується, тобто рівновага зміщується у напрямку прямої реакції.
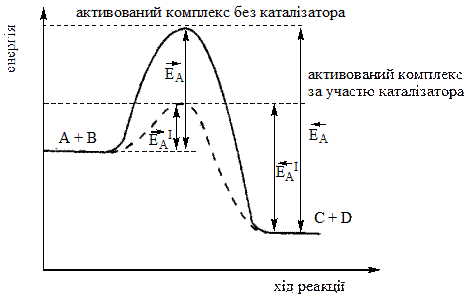
У присутності каталізатора енергія активації і прямої, і зворотної реакцій знижується на одну і ту ж величину. Тому швидкість обох реакцій збільшується однаковою мірою. Отже, каталізатор скорочує час досягання рівноваги, але не впливає на його зміщення.
До такого висновку можна дійти, аналізуючи рівняння (6.25).
Зміна енергії Гіббса реакції ∆GТ не залежить від шляху її перебігу. Тому значення ∆GТ і константи рівноваги реакції, отже, і рівноважні концентрації усіх учасників реакції залишаються незмінними незалежно від того, чи відбувається реакція без каталізатора, чи у його присутності.
На наведеній далі енергетичній схемі оборотної реакції:
- 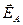 ,
, 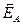 – енергія активації прямої та зворотної реакцій без каталізатора,
– енергія активації прямої та зворотної реакцій без каталізатора,
-  ,
,  – енергія активації прямої та зворотної реакцій у присутності каталізатора:
– енергія активації прямої та зворотної реакцій у присутності каталізатора:
Приклад 1. За законом діючих мас запишіть кінетичні рівняння прямої та зворотної реакцій в оборотній системі:
2СО(г) + О2(г)  2СО2(г)
2СО2(г)
Як і у скільки разів зміниться швидкість реакцій, якщо об’єм газової суміші зменшити у три рази? Вкажіть напрямок зміщення рівноваги.
Розв’язання.
Реакція належить до гомогенних, тому що всі реагуючі речовини перебувають у газовій фазі. За законом діючих мас запишемо кінетичні рівняння прямої та зворотної реакцій (6.12), (6.13):
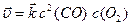 ,
,
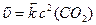
Зі зменшенням об’єму системи у 3 рази концентрація кожної речовини збільшується у 3 рази:
с1(СО) = 3с(СО); с1(О2) = 3с(О2); с1(СО2) = 3с(СО2)
За нових концентрацій швидкості реакцій дорівнюють:
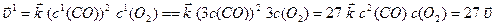 ,
,
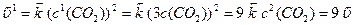
Отже, швидкість прямої реакції збільшується у 27 разів, а зворотної – у 9 разів. Через те, що 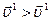 , рівновага зміщується у напрямку прямої реакції.
, рівновага зміщується у напрямку прямої реакції.
Приклад 2. За законом діючих мас запишіть кінетичні рівняння прямої та зворотної реакцій в оборотній системі:
Si(т) + 2H2(г)  SiH4(г)
SiH4(г)
Як і у скільки разів зміниться швидкість реакцій за зниження тиску в системі у 4 рази? Вкажіть напрямок зміщення рівноваги.
Розв’язання.
Реакція є гетерогенною, оскільки реагуючі речовини перебувають у різних фазах: Si – у твердій фазі, а Н2 та SiH4 – у газовій.
Запишемо кінетичні рівняння реакцій, враховуючи, що за сталої площі поверхні твердої речовини, швидкість реакції залежить від концентрації лише газуватих речовин (6.5):
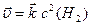 ,
,
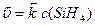
Зі зниженням тиску у системі у 4 рази, концентрації газуватих речовин теж зменшуються у стільки ж разів:
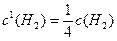 ,
, 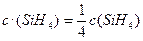
За нових концентрацій швидкості реакцій дорівнюють:
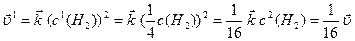 ,
,
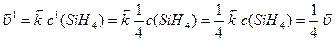
Отже, швидкість прямої реакції зменшується у 16 разів, а зворотної – у 4 рази. Тобто за нових концентрацій реагуючих речовин зворотна реакція відбувається з більшою швидкістю, ніж пряма (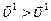 ), і рівновага зміщується у напрямку зворотної реакції.
), і рівновага зміщується у напрямку зворотної реакції.
Приклад 3. Тривалість реакції за температури 400 К становить 182 хвилини, а за температури 420 К – 20 хвилин. Розрахуйте значення температурного коефіцієнта g швидкості реакції.
Розв’язання.
Визначимо, у скільки разів зменшиться тривалість реакції за підвищення температури на 20 К:
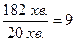
Отже, швидкість реакції збільшилась у 9 разів:
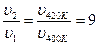
За правилом Вант-Гоффа (6.11) обчислимо значення температурного коефіцієнта швидкості реакції:
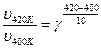 ,
, 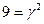
Звідки: 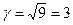
Приклад 4. У скільки разів зменшиться швидкість реакції, яка відбувається за рівнянням:
2А(г) + В(г) = 2С(г),
зі зменшенням парціального тиску вихідних речовин у 2 рази і одночасно зі зниженням температури на 30 К? Температурний коефіцієнт g швидкості реакції дорівнює 4.
Розв’язання.
Реакція є гомогенною, оскільки всі реагуючі речовини газуваті. За законом діючих мас запишемо кінетичне рівняння реакції (6.4):
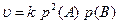 ,
,
де р(А) та р(В) – початковий парціальний тиск вихідних речовин.
Зі зниженням парціального тиску вихідних речовин швидкість реакції дорівнює:
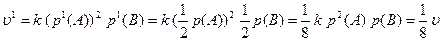
Отже, зі зниженням парціального тиску вихідних речовин швидкість реакції зменшиться у 8 разів.
Розрахуємо за правилом Вант-Гоффа (6.11), у скільки разів зменшиться швидкість реакції зі зниженням температури на 30К, тобто, якщо (Т2 - Т1) = -30К:
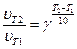 ,
, 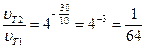
Отже, зі зниженням температури на 30К швидкість реакції зменшиться у 64 рази.
Загалом зі зниженням парціального тиску речовин і одночасно зі зниженням температури швидкість реакції зменшиться у 8×64, тобто у 512 разів.
Приклад 5. Оборотна реакція відбувається за таким рівнянням:
C2H6 (г)  C2H2 (г) + 2H2 (г), ΔН0 =?
C2H2 (г) + 2H2 (г), ΔН0 =?
Наведіть вираз константи рівноваги та визначте, екзо- чи ендотермічною є ця реакція, якщо за підвищення температури рівновага зміщується у напрямку прямої реакції. Чи впливає на стан рівноваги підвищення тиску; введення каталізатора?
Розв’язання.
Оскільки всі реагуючі речовини газуваті, реакція є гомогенною.
Константа рівноваги дорівнює (6.14):
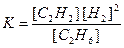
За принципом Ле Шательє за підвищення температури рівновага зміщується у напрямку ендотермічної реакції, яка відбувається з поглинанням енергії і супроводжується зниженням температури. Отже, пряма реакція у наведеному прикладі є ендотермічною (DН>0).
Підвищення тиску сприяє зміщенню рівноваги у напрямку зворотної реакції, під час перебігу якої з 3 моль газуватих речовин утворюється 1 моль, що призводить до зниження тиску в системі.
Введення каталізатора однаковою мірою збільшує швидкість прямої та зворотної реакцій. Тому каталізатор не впливає на стан рівноваги, а лише прискорює його досягнення.
Приклад 6. Запишіть вираз константи рівноваги оборотної реакції:
CaO (т) + CO2 (г)  CaCO3 (т), ΔН0 < 0
CaCO3 (т), ΔН0 < 0
Зміною яких параметрів системи можна змістити рівновагу у напрямку зворотної реакції?
Розв’язання.
Реакція є гетерогенною, оскільки реагуючі речовини перебувають у різних фазах. Запишемо вираз константи рівноваги (6.14), беручи до уваги, що у вираз константи рівноваги входить концентрація лише газуватої речовини СО2:
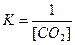
За приципом Ле Шательє зміщенню рівноваги у зворотному напрямку сприяють:
а) зниження тиску (шляхом збільшення об’єму системи), оскільки внаслідок перебігу зворотної реакції з твердої речовини СаСО3 утворюється газ СО2, що спричинює підвищення тиску;
б) підвищення температури, тому що зворотна реакція є ендотермічною (DН>0) і супроводжується зниженням температури;
в) виведення зі сфери реакції газу СО2, що призводить до зменшення його концентрації, і рівновага зміщується у напрямку утворення СО2.
Приклад 7. У якому агрегатному стані перебуває речовина А, якщо за підвищення тиску рівновага системи
А + В (г)  С (г), ΔН0 < 0
С (г), ΔН0 < 0
не зміщується?
Наведіть вираз константи рівноваги. Як впливає на стан рівноваги:
а) зниження температури;
б) збільшення концентрації речовини С?
Розв’язання.
За принципом Ле Шательє зміна тиску не спричинює зміщення рівноваги в тому випадку, якщо кількість газуватих вихідних речовин дорівнює кількості газуватих продуктів реакції. Отже, ця реакція відбувається без зміни кількості газуватих речовин (1моль речовини В та 1моль речовини С), якщо речовина А перебуває у твердому стані.
Запишемо вираз константи рівноваги (6.14), враховуючи, що ця реакція гетерогенна і у вираз константи рівноваги не входить концентрація твердої речовини А:
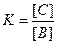
За принципом Ле Шательє:
а) зниження температури сприяє зміщенню рівноваги у напрямку екзотермічної реакції, якою є пряма реакція (ΔН0 < 0);
б) збільшення концентрації речовини С зміщує рівновагу у напрямку зворотної реакції. Внаслідок перебігу зворотної реакції речовина С перетворюється у речовини А та В і її концентрація зменшується.
Приклад 8. Розрахуйте константу рівноваги реакції за температури 300 К, якщо зміна стандартної енергії Гіббса реакції дорівнює “-57,3 кДж/моль”.
Розв’язання.
Константа рівноваги пов’язана зі зміною енергії Гіббса реакції рівнянням (6.22):
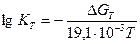 ;
; 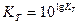
Підставимо в цей вираз значення DGТ та температури Т і одержуємо:
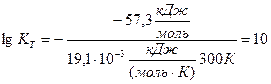
Звідки: КТ=1010.
Приклад 9. У скільки разів збільшиться швидкість реакції у присутності каталізатора за температури 298 К, якщо її енергія активації зменшилась на 25,1 кДж/моль?
Розв’язання.
Якщо позначити енергію активації реакції без каталізатора ЕА, а у присутності каталізатора – ЕА1; відповідні константи швидкості реакції – k та k1, то за рівнянням Арреніуса (6.7) знаходимо:
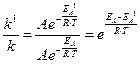
Звідки:
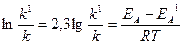
Підставляємо у цей вираз величину зниження енергії активації реакції у присутності каталізатора, значення універсальної газової сталої (R=8,31∙10-3 кДж/(моль∙К)) та температури:
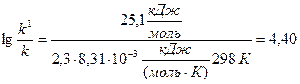 ;
; 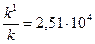
Отже, за зменшення енергії активації реакції на 25,1 кДж/моль внаслідок введення каталізатора швидкість реакції зросла у 25 тисяч (25100) разів.
Приклад 10. Розрахуйте енергію активації реакції, швидкість якої за температури 300 К у 10 разів більша, ніж за температури 280 К.
Розв’язання.
Позначимо константу швидкості реакції за температури Т1=280 К – k1, а за температури Т2=300 К – k2. За рівнянням Арреніуса (6.7) знаходимо:
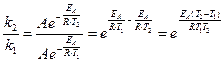
Логарифмуємо цей вираз:
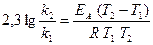
Підставляємо значення Т2, Т1 та газової сталої і визначаємо енергію активації реакції:
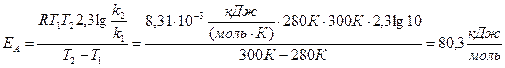
Отже, енергія активації реакції дорівнює:
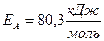 .
.
Приклад 11. Визначте, чи можна використовувати марганець у якості розкисника під час зварювання сталі. Відомо, що тиск дисоціації ферум (ІІ) оксиду за температури 2000 К дорівнює 10-3 кПа, а манган (ІІ) оксиду – 10-8 кПа.
Розв’язання.
Розкиснення – це процес видалення з розплавленого металу кисню, який знаходиться у складі сталі у вигляді ферум (ІІ) оксиду і погіршує механічні властивості сталі. Розкиснення здійснюється введенням у розплав сталі розкисників – елементів з більшою спорідненістю до оксигену, ніж залізо, яке є основою сталі. Отже, розкисником може бути елемент, оксид якого є стійкішим за ферум (ІІ) оксид.
Визначити, який з оксидів є стійкішим, можна порівнюючи тиск їх дисоціації: чим менше тиск дисоціації оксиду, тим більш стійким є оксид.
Запишемо рівняння термічної дисоціації вказаних в умові оксидів у загальному вигляді (6.16):
2МеO (Т)  2Ме (Т) + O2 (Г)
2Ме (Т) + O2 (Г)
Оскільки ці реакції є гетерогенними, тобто відбуваються на поверхні поділу між твердою та газуватою фазами, то константа рівноваги визначається лише тиском кисню (6.17):
КТ = р(О2)
Рівноважний тиск кисню р(О2), який утворюється у замкненій системі внаслідок розкладу оксидів за нагрівання, і є тиском дисоціації оксидів.
Тиск дисоціації манган (ІІ) оксиду (10-8 кПа) менший за тиск дисоціації ферум (ІІ) оксиду (10-3 кПа), отже MnO є більш стійким ніж FeO. Тому у якості розкисника можна використовувати марганець, який реагує з ферум (ІІ) оксидом за таким рівнянням:
Mn + FeO = MnO + Fe.
Таким чином, кількість FeO у складі сталі зменшується.
Приклад 12. Визначте, чи буде окиснюватись срібло за температури 2000С у присутності атмосферного кисню? Відомо, що тиск дисоціації аргентум оксиду за цієї температури дорівнює 175 кПа, а парціальний тиск атмосферного кисню становить 21 кПа.
Розв’язання.
Запишемо рівняння термічної дисоціації арґентум оксиду (6.16) та вираз константи її рівноваги (6.17):
2Ag2O (Т)  4Ag (Т) + O2 (Г)
4Ag (Т) + O2 (Г)
КТ = р(О2)
Порівнюємо парціальний тиск атмосферного кисню Р(О2) і тиск кисню, утвореного в замкненій системі внаслідок розкладу оксиду, який дорівнює тиску дисоціації арґентум оксиду р(О2):
Р(О2)=21 кПа < р(О2)=175 кПа.
Отже, у присутності атмосферного кисню його тиск у системі, що розглядається, зменшується.
За принципом Ле Шательє рівновага зміщується у напрямку реакції, яка протидіє цій зміні, тобто у напрямку реакції розкладу арґентум оксиду, яка супроводжується підвищенням тиску кисню.
Отже, за даної температури срібло у присутності атмосферного кисню не окиснюється.
Приклад 13. Для забезпечення газового захисту зони зварювання від доступу повітря в деяких випадках використовують вуглекислий газ. Визначте, чи виключає такий захист можливість окиснення алюмінію за температури 2500 К. Вуглекислий газ подається у зону зварювання під тиском 101,3 кПа, а ступінь термічної дисоціації вуглекислого газу за цієї температури становить 0,014.
Розв’язання.
Запишемо рівняння термічної дисоціації алюміній оксиду (6.16) та вираз її константи дисоціації (6.17):
2Al2O3 (Т)  4Al (Т) + 3O2 (Г)
4Al (Т) + 3O2 (Г)
К = р3(О2)
В таблиці Д.2 наведено значення стандартної ентальпії утворення алюміній оксиду DН0(Al2O3). За законом Лавуазьє-Лапласа стандартний тепловий ефект розкладу кількості алюміній оксиду 1 моль на прості речовини дорівнює стандартній ентальпії його утворення, але з протилежним знаком. Отже, з врахуванням кількості алюміній оксиду в реакції, що розглядається, стандартний тепловий ефект цієї реакції дорівнює:
DН0 = - 2·DН0(Al2O3) = - 2 моль·(-1676 кДж/моль) = 3352 кДж,
Розрахуємо зміну стандартної ентропії реакції, використовуючи дані, наведені в таблиці Д.4:
DS0 = 4·S0(Al) + 3·S0(O2) – 2·S0(Al2O3) = 4 моль·28 Дж/(моль·К) +
+ 3 моль·205 Дж/(моль·К) – 2 моль·51 Дж/(моль·К) = 625 Дж/К.
Обчислимо зміну енергії Гіббса реакції за температури 2500 К (6.23):
DG2500 = DН0 – ТDS0 = 3352 кДж – 2500 К·0,625 кДж/К= 1789,5 кДж
Визначимо тиск дисоціації алюміній оксиду (6.24):
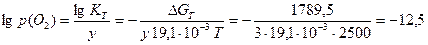 ,
,
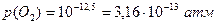 , або
, або 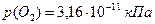
Напишемо рівняння розкладу вуглекислого газу за нагрівання:
2CO2 (Г)  2СО (Г) + O2 (Г)
2СО (Г) + O2 (Г)
Оскільки ступінь дисоціації вуглекислого газу показує, яка частка його кількості розкладається і, враховуючи, що кількість утвореного кисню у два рази менша:

Порівняємо тиск дисоціації алюміній оксиду р(О2) та тиск кисню, утвореного внаслідок розкладу вуглекислого газу Р(О2):
р(О2) =10-12,5 кПа < Р(О2) = 0,7 кПа
Оскільки тиск кисню у присутності вуглекислого газу значно зростає, то за принципом Ле Шательє рівновага реакції розкладу алюміній оксиду зміщується у напрямку зниження його тиску, тобто у напрямку зворотної реакції. Отже, такий захист не виключає окиснення алюмінію.
РОЗДІЛ ІІІ. РОЗЧИНИ
7. ПРИРОДА РОЗЧИНІВ ТА СПОСОБИ ВИРАЖЕННЯ ЇХ СКЛАДУ
Розчини - це двох- або більшкомпонентні гомогенні (однорідні) системи, склад яких може змінюватись у широких межах.
Компонентами розчину є розчинник та розчинена речовина. За агрегатним станом розчини бувають газуваті, рідкі та тверді.
Газуваті розчини - це суміші газів, наприклад, повітря.
Тверді розчини здебільшого отримують під час спільної кристалізації рідких розчинів або розплавів. Так, твердий розчин утворюється під час кристалізації розплаву срібла та золота. До твердих розчинів належать розчин вуглецю в залізі, розчини водню в паладії та платині, змішані кристали KCl – KBr тощо.
Рідкі розчини утворюються під час розчинення газуватих, рідких або твердих речовин у рідині. Якщо рідкий розчин утворюється внаслідок розчинення газуватої або твердої речовини у рідині, то за розчинника вважають рідину, тобто той компонент розчину, агрегатний стан якого не змінюється. Якщо рідкий розчин утворюється при змішуванні двох або більше рідин, то розчинник у кількісному відношенні переважає розчинену в ньому речовину.
Склад розчинів, як і склад механічних сумішей, може змінюватись у досить широких межах. Розчини, як і суміші, можна досить легко розділити на складові частини. Але своєю однорідністю розчини нагадують хімічні сполуки. Крім того, процес розчинення, як і процес утворення хімічних сполук, супроводжується певним тепловим ефектом, зміною об'єму, як, наприклад, під час розчинення спиртів або сульфатної кислоти у воді, забарвленням розчинів, наприклад, внаслідок розчинення білого купрум (II) сульфату CuSO4 у воді утворюється синій розчин.
Отже, розчини можна розглядати, як перехідний стан речовин між хімічними сполуками та механічними сумішами.
Розчинення - це фізико-хімічний процес, що складається з окремих стадій, які відбуваються одночасно.
Внаслідок взаємодії частинок розчинюваної речовини з молекулами розчинника утворюються нестійкі хімічні сполуки. Ця стадія розчинення речовини називається сольватацією, а якщо розчинник - вода, то гідратацією, і утворені сполуки називаються відповідно сольватами або гідратами. Процес сольватації відбувається з виділенням енергії, тобто є екзотермічним:
DHсольв.<0.
Одночасно зі сольватацією відбувається руйнування зв'язків між частинками речовини, що розчиняється, а якщо розчинювана речовина є твердою, то руйнування її кристалічної решітки. Ця стадія розчинення речовини потребує витрати енергії, тобто є ендотермічним процесом:
DHруйн.>0.
Тепловий ефект розчинення DHрозч. дорівнює алгебраїчній сумі теплових ефектів окремих стадій:
DHрозч. = DHсольв. + DHруйн.
Якщо |DHруйн.|>|DHсольв.|, тобто, якщо руйнування зв'язків між частинками розчинюваної речовини потребує витрати більшої кількості енергії, ніж кількість енергії, що виділяється внаслідок сольватації, то розчинення - процес ендотермічний: DHрозч.>0. Наприклад, розчинення NH4Cl у воді відбувається з поглинанням енергії.
Якщо |DHсольв.|>|DHруйн.|, тобто під час утворення сольватів виділяється більша кількість енергії, ніж витрачається на руйнування зв'язків між частинками розчинюваної речовини, тоді розчинення супроводжується виділенням енергії: DHрозч.<0. Наприклад, розчинення NaOH у воді є екзотермічним процесом.
Розчинення газів у воді – завжди екзотермічний процес, тому що витрата енергії на руйнування слабких міжмолекулярних зв'язків незначна (DHруйн.→0). Отже, DHрозч.≈ DHсольв.. Оскільки DHсольв.<0, то і DHрозч.<0.
Розчинення речовини відбувається довільно, якщо DG<0, а величина DG залежить від співвідношення ентальпійного (DН) та ентропійного (TDS) факторів, які зв'язані між собою рівнянням: DG = DH – TDS
Розчинення газів у воді супроводжується виділенням енергії (DHрозч.<0) та зменшенням ступеня невпорядкованості системи, отже і зменшенням ентропії (DS<0). Тому DG<0, якщо |DHрозч.|>|TDS|, тобто розчинення газів у воді відбувається за низьких температур.
Розчинення твердих речовин, якщо розчин – рідина, здебільшого проходить з поглинанням енергії (DHрозч.>0) і супроводжується зростанням ентропії (DS>0) внаслідок збільшення ступеня невпорядкованості системи. Тому DG<0, якщо |TDS|>|DHрозч.|, тобто розчиненню твердих речовин сприяє підвищення температури. Але, якщо |DHрозч.| >> |ТDS|, то DG>0 і розчинення твердої речовини неможливе навіть і за нагрівання. За будь-яких температур тверда речовина розчиняється (DG<0), якщо її розчинення – процес екзотермічний (DHрозч.<0).
Розчинення речовини у рідкому розчиннику – процес оборотний, тобто по мірі розчинення і збільшення її концентрації у розчині, стає можливим виділення речовини з розчину. Розчин, в якому встановлюється динамічна рівновага між речовиною у розчині та нерозчиненою речовиною, називається насиченим. У насиченому розчині швидкість розчинення речовини дорівнює швидкості її виділення з розчину, тобто скільки частинок речовини за одиницю часу переходить у розчин, стільки ж їх виділяється з розчину. Отже, у насиченому розчині за певної температури міститься максимальна кількість розчиненої речовини.
Концентрація речовини у насиченому розчині є мірою розчинності речовини. У ненасиченому розчині концентрація речовини менша, а у пересиченому – більша, ніж концентрація речовини у насиченому розчині. Пересичені розчини утворюються при повільному і обережному охолодженні насичених розчинів. Пересичені розчини – нестійкі і внесення до розчину кристала розчинюваної речовини спричиняє випадання її надлишку в осад.
Розчинність речовини залежить від природи розчинюваної речовини та розчинника. За старовинним правилом: подібне розчиняється у подібному. Якщо молекули розчинника неполярні (бензол, ефір), то в ньому добре розчиняються речовини, молекули яких теж неполярні або малополярні, наприклад CO, I2. І навпаки, речовина, яка складається з полярних молекул, добре розчиняється у полярних розчинниках, як, наприклад, спирт у воді.
Для визначення залежності розчинності речовини від температури можна застосувати принцип Ле Шательє. Розчинення більшості твердих речовин у воді - процес ендотермічний, тому їх розчинність за нагрівання зростає. Розчинення газів у воді - екзотермічний процес, тому підвищення температури зменшує іх розчинність.
При змішуванні рідин можливі такі випадки. Деякі рідини необмежено розчинні одна в одній, як, наприклад, спирт і вода. Інші - взаємно розчиняються до певної межі, наприклад, вода та ефір. За підвищення температури взаємна розчинність рідин збільшується і за температури, яка називаєтеся критичною, стає необмеженою.
Розчинення твердих та рідких речовин у рідині майже не супроводжується зміною об'єму. Тому їх розчинність практично не залежить від тиску. Під час розчинення газів у рідині об'єм системи значно зменшується, тому підвищення тиску призводить до збільшення розчинності газів. Залежність розчинності газів від тиску виражається законом Генрі-Дальтона:
“Розчинність газу в рідині за сталої температури прямо пропорційна його парціальному тиску.”
Способи вираження складу розчинів
Масова частка речовини ω(B) -це відношення маси розчиненої речовини m(B) до маси розчину mp:
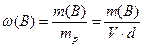 , (7.1)
, (7.1)
де V (л) та d (г/л) – відповідно об’єм та густина розчину, а маса розчину дорівнює:
mp= V·d (7.2)
Масова частка - безрозмірна величина, що показує яку частку складає маса розчиненої речовини від маси усього розчину.
Масова концентрація речовини r(B) - це відношення маси розчиненої речовини m(В) до об'єму розчину V:
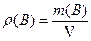 (7.3)
(7.3)
Масова концентрація вимірюється у г/л.
Молярна концентрація речовини с(В) - це відношення кількості розчиненої речовини n(B) до об'єму розчину V:
 , (7.4)
, (7.4)
де кількість розчиненої речовини дорівнює: 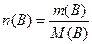 (1.7).
(1.7).
Молярна концентрація вимірюється у моль/л.
Молярна частка речовини χ(В) - це відношення кількості розчиненої речовини n(В) до загальної кількості розчиненої речовини та розчинника:
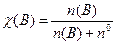 , (7.5)
, (7.5)
де n0 - кількість розчинника.
Молярна частка - безрозмірна величина, що показує яку частку складає кількість розчиненої речовини від загальної кількості розчиненої речовини та розчинника.
Моляльність речовини сm(B) – це відношення кількості розчиненої речовини n(В) до маси розчинника mр-ка:
 (7.6)
(7.6)
Моляльність вимірюється у моль/(кг розчинника).
Приклад 1. У воді об`ємом 300 мл розчинили натрій хлорид масою 20 г. Густина води дорівнює 1000 г/л. Розрахуйте масову частку NaCl у розчині.
Розв'язання.
Визначимо масу розчинника (води):
m(H2O) = V(H2O) · d(H2O) = 0,3 л · 1000 г/л =300 г
Маса розчину дорівнює:
mр = m(NaCl) + m(H2O) = 20 г + 300 г =320 г
Розрахуємо масову частку NaCl у розчині (7.1):
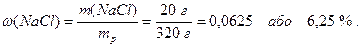
Приклад 2. Розрахуйте об`єм водного розчину з масовою часткою калій карбонату 10%, в якому міститься K2CO3 масою 54,5 г. Густина розчину становить 1090 г/л.
Розв'язання.
Обчислюємо масу розчину (7.1):
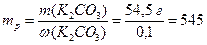 г.
г.
Об`єм розчину дорівнює (7.2):
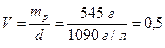 л.
л.
Приклад 3. Водний розчин об`ємом 400 мл містить кількість сульфатної кислоти 0,8 моль. Обчисліть масову концентрацію H2SO4 у розчині.
Розв'язання.
Розрахуємо масу сульфатної кислоти (1.7):
m(H2SO4) = n(H2SO4) · M(H2SO4) = 0,8 моль · 98 г/моль = 78,4 г.
Обчислимо масову концентрацію H2SO4 у розчині (7.3):
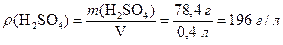 .
.
Приклад 4. Визначте молярну концентрацію натрій сульфату у розчині, добутому внаслідок розчинення Na2SO4 масою 106,5 г у воді масою 750 г. Густина розчину дорівнює 1120 г/л.
Розв'язання.
Кількість розчиненого натрій сульфату становить (1.7):
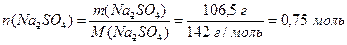 .
.
Обчислимо масу добутого розчину:
mp= m(Na2SO4) + m(H2O) = 106,5 г + 750 г = 856,5 г
Об`єм розчину дорівнює (7.2): 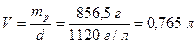 .
.
Розрахуємо молярну концентрацію натрій сульфату у розчині (7.4):
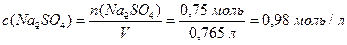 .
.
Приклад 5. Розрахуйте масу калій нітрату, необхідну для приготування водного розчину об’ємом 2 л з молярною концентрацією KNO3 0,1 моль/л.
Розв'язання.
Визначимо кількість калій нітрату, необхідну для приготування розчину об`ємом 2 л (7.4):
n(KNO3) = c(KNO3) · V = 0,1 моль/л · 2 л = 0,2 моль.
Розрахуємо масу цієї кількості калій нітрату (1.7):
m(KNO3) = n(KNO3) · M(KNO3) = 0,2 моль · 101 г/моль = 20,2 г.
Приклад 6. Розрахуйте молярну частку карбаміду у водному розчині з масовою часткою CO(NH2)2 30% (0,3 в частках від одиниці).
Розв'язання.
За виразом (7.1) маса розчиненої речовини дорівнює:
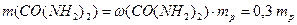
Сума масових часток усіх компонентів розчину становить 1, тому масова частка води та її маса дорівнюють:
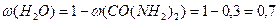
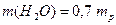
Кількість компонентів розчину визначається за виразом (1.7):
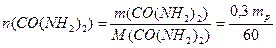 ,
,
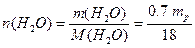 .
.
Розрахуємо молярну частку карбаміду у розчині (7.5):
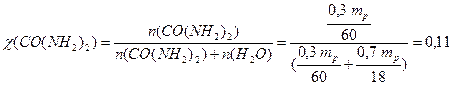 ,
,
де M(CO(NH2)2)=60 г/моль, M(H2O)=18 г/моль.
Приклад 7. Розрахуйте моляльність глюкози C6H12O6 у розчині, який отримали під час розчинення глюкози масою 18 г у воді масою 200 г.
Розв'язання.
Визначимо кількість глюкози у розчині (1.7):
 .
.
Моляльність глюкози у розчині дорівнює (7.6):
 моль/кг H2O.
моль/кг H2O.
|
|
Дата добавления: 2015-05-23; Просмотров: 3472; Нарушение авторских прав?; Мы поможем в написании вашей работы!