
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типи електродів
|
|
|
|
Металічний електрод – це металічна пластина, занурена у розчин солі цього металу.
Схема металічного електрода:
Men+ | Me, Men+ + ne–  Me0
Me0
У схемі зліва від вертикальної риси, якою позначають межу поділу між електродом та електролітом, вказують йони металу у розчині солі, а справа – метал електрода. Поряд наведено рівняння рівноважного електродного процесу, який відбувається на поверхні металу, де Men+ – окиснена форма металу (Ох), а Me0 – його відновлена форма (Red).
Враховуючи, що концентрація твердої речовини, тобто концентрація металу у вільному стані (Red) – величина стала, рівняння Нернста (10.5) для металічного електрода має такий вигляд:
 (10.6)
(10.6)
де n – кількість електронів в електродному процесі, яка чисельно збігається з зарядом йонів Men+, а [Men+] – концентрація йонів Men+ у розчині.
За стандартних умов:
- Т=298 К,
- [Men+]= 1 моль/л;
потенціал металічного електрода є стандартним:  .
.
Стандартні потенціали металічних електродів наведені в таблиці Д. 6.
До газових електродів належать електроди, на поверхні яких відбувається електродний процес за участю газуватої речовини.
У якості металічного провідника використовують платинову пластину з таких причин:
– платина – неактивний метал, тобто не приймає участі безпосередньо в електродному процесі;
– платина є каталізатором електродного процесу, тобто прискорює встановлення рівноваги електродного процесу на межі поділу між електродом та електролітом.
У водневому електроді пластина платини занурена у розчин сульфатної кислоти, через який продувають газ водень. На поверхні пластини, яка омивається воднем, відбувається адсорбція, тобто поглинання платиною молекул водню. Для збільшення площі поверхні і для покращення адсорбції пластину вкривають подрібненою губчастою платиною.
|
|
|
Схема водневого електрода:
H+ | H2, Pt, 2H+ + 2e–  H20
H20
Зліва від вертикальної риси вказані йони гідрогену Н+ у розчині сульфатної кислоти (H2SO4 = 2H+ + SO42–), справа – молекули Н2, які знаходяться на поверхні платини. Поряд наведено рівняння рівноважного електродного процесу, в якому окисненою формою гідрогену (Ох) є йони Н+, а відновленою (Red) – молекули Н2.
За рівнянням Нернста (10.5) потенціал водневого електрода дорівнює: 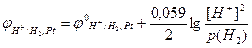
За стандартних умов:
- Т=298 К,
- парціальний тиск водню р(Н2)=101,3 кПа (умовна одиниця),
- концентрація йонів гідрогену [Н+]=1 моль/л, тобто рН розчину дорівнює 0;
потенціал водневого електрода є стандартним і умовно приймається за 0:

Якщо концентрація йонів гідрогену [Н+] ≠ 1 моль/л, то рівняння Нернста для водневого електрода має вигляд:
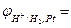 0,059lg[H+] (10.7)
0,059lg[H+] (10.7)
Враховуючи, що рН = – lg [H+], потенціал водневого електрода дорівнює:
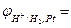 – 0,059рН (10.8)
– 0,059рН (10.8)
У кисневому електроді платинова пластина занурена у розчин лугу, через який продувають газ кисень. Молекули О2, що поглинаються поверхнею платини, знаходяться у рівновазі з йонами ОН– у розчині, які утворюються внаслідок дисоціації лугу (KOH=K+ + OH–).
Схема кисневого електрода:
OH– | O2, Pt, O20 + 4e– +2H2O  4OH–
4OH–
В рівнянні електродного процесу окисненою формою оксигену (Ох) є молекули О2, а відновленою (Red) – йони ОН–, в яких ступінь окиснення атомів оксигену дорівнює “-2”.
Рівняння Нернста для кисневого електрода:

За стандартних умов:
- Т=298 К,
- парціальний тиск кисню р(О2)=101,3 кПа (умовна одиниця),
- концентрація гідроксид-йонів у розчині [ОН–]=1 моль/л, тобто рОН розчину дорівнює 0, а рН=14;
потенціал кисневого електрода є стандартним і дорівнює (Табл. Д.7):
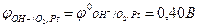
Якщо концентрація гідроксид-йонів [ОН–] ≠ 1 моль/л, то потенціал кисневого електрода розраховують за виразом:
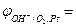 1,23 – 0,059рH (10.9)
1,23 – 0,059рH (10.9)
У хлорному електроді платинова пластина занурена у розчин солі калій хлориду KCl, через який продувають газ хлор.
|
|
|
Схема хлорного електрода:
Cl– | Cl2, Pt, Cl20 + 2e–  2Cl–
2Cl–
В рівнянні електродного процесу окисненою формою хлору (Ох) є молекули Cl2, а відновленою (Red) – йони Cl–, які утворюються у розчині внаслідок дисоціації солі (KCl=K+ + Cl–).
Рівняння Нернста (10.5) для хлорного електрода має такий вигляд:

За стандартних умов:
- Т=298 К,
- парціальний тиск хлору р(Cl2)=101,3 кПа (умовна одиниця),
- концентрація хлорид-йонів у розчині [Cl–]=1 моль/л;
потенціал хлорного електрода є стандартним і дорівнює (Табл. Д.7):

Окисно-відновні електроди (редокс-електроди) – це всі інші електроди окрім металічних та газових. Отже, в електродних процесах цих електродів не приймають безпосередньої участі метали та гази. В редокс-електродах за таких же причин, як і в газових, у якості металічного провідника використовують платинову пластину. У більшості ця пластина знаходиться у контакті з розчином, в якому міститься і окиснена (Ох), і відновлена (Red) форми учасника електродного процесу.
Прикладом редокс-електрода є платинова пластина, занурена у розчин суміші солей FeCl2 та FeCl3, які дисоціюють з утворенням йонів Fe2+ та Fe3+.
Схема цього редокс-електрода:
Fe3+, Fe2+ | Pt; Fe3+ + e–  Fe2+
Fe2+
Окисненою формою (Ох) є йони Fe3+, а відновленою (Red) – йони Fe2+. Рівняння Нернста для вказаного редокс-електрода має такий вигляд:
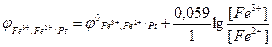
За стандартних умов:
- Т=298 К;
- концентрація йонів: [Fe3+]=1 моль/л та [Fe2+]=1 моль/л;
потенціал електрода є стандартним і дорівнює (Табл. Д.7):

У більш складних редокс-електродах в електродному процесі беруть участь, окрім окисненої та відновленої форм речовини, йони Н+ або ОН–. Прикладом є редокс-електрод, схема якого наведена нижче:
MnO4–, Mn2+, H+ | Pt, MnO4– + 5e– + 8H+  Mn2+ + 4H2O
Mn2+ + 4H2O
За рівнянням Нернста (10.5) потенціал такого редокс-електрода дорівнює:
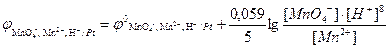
За стандартних умов:
- Т=298 К,
- [MnO4-]=1 моль/л, [Mn2+]=1 моль/л, [H+]=1 моль/л;
потенціал електрода є стандартним і дорівнює (Табл. Д.7):
 .
.
Вимірювання електродних потенціалів
Для того, щоб виміряти потенціал окремого електрода, тобто потенціал, який виникає на межі поділу між електродом та електролітом, потрібно приєднати до вимірювального приладу не тільки сам електрод, а і розчин електроліту. Для цього необхідно занурити у розчин електроліту металічний дріт, який в ту ж мить стає електродом. Таким чином, за вимірювальним приладом можна визначити тільки різницю між потенціалами двох електродів. Отже, абсолютне значення потенціалу окремого електрода виміряти неможливо.
|
|
|
Тому потенціал окремого електрода вимірюють відносно стандартного водневого електрода, тобто електрода, потенціал якого за стандартних умов вважають за 0. Для цього складають гальванічний елемент, в якому один з електродів є досліджуваний, а інший – стандартний водневий електрод.
Якщо потенціал досліджуваного електрода менший за потенціал стандартного водневого електрода, то досліджуваний електрод є анодом, а стандартний водневий – катодом.
Нижче наведена схема такого гальванічного елемента:
(Анод) досліджуваний електрод | електроліт || Н+ | H2, Pt (Катод)
“–” “+”
Електрорушійна сила ГЕ дорівнює:
Е = φ катода – φ анода = φ0 Н+ | H2, Pt – φ дослідж. електрода
Якщо потенціал досліджуваного електрода також є стандартним, то електрорушійна сила ГЕ називається стандартною і позначається Е0:
Е0 = φ0 Н+ | H2, Pt – φ0дослідж. електрода
Оскільки φ0 Н+ | H2, Pt = 0, тоді потенціал досліджуваного електрода дорівнює:
φ дослідж. електрода = – Е,
а стандартний потенціал досліджуваного електрода:
φ0дослідж. електрода = – Е0
Якщо потенціал досліджуваного електрода більший за потенціал стандартного водневого електрода, то досліджуваний електрод є катодом, а стандартний водневий електрод – анодом.
Схема гальванічного елемента:
(Анод) Pt, H2 | Н+ || електроліт | досліджуваний електрод (Катод)
“–” “+”
Електрорушійна сила такого ГЕ дорівнює:
Е = φ дослідж. електрода – φ0 Н+ | H2, Pt,
а його стандартна електрорушійна сила:
Е0 = φ0дослідж. електрода – φ0 Н+ | H2, Pt
В такому випадку потенціал досліджуваного електрода та його стандартний потенціал дорівнюють:
φдослідж. електрода = Е,
φ0дослідж. електрода = Е0
Отже, стандартний електродний потенціал – це виміряна за стандартних умов електрорушійна сила гальванічного елемента, який складається з досліджуваного електрода та водневого електрода.
|
|
|
Приклад 1. Складіть схему гальванічного елемента (ГЕ), в якому пластини алюмінію та міді занурені у розчини своїх солей з концентрацією йонів Al3+ та Cu2+, що дорівнює відповідно 0,001 та 0,1 моль/л.
Напишіть рівняння електродних процесів та струмоутворюючої реакції. Розрахуйте: а) електрорушійну силу ГЕ; б) зміну стандартної енергії Гіббса струмоутворюючої реакції ΔG0; в) стандартну енергію Гіббса утворення йонів Cu2+, якщо відомо, що стандартна енергія Гіббса утворення йонів Al3+ дорівнює: ΔG0(Al3+)= – 481 кДж/моль.
Розв’язання. Розрахуємо за рівнянням Нернста для металічних електродів (10.6) потенціали пластин алюмінію та міді:
 ,
,
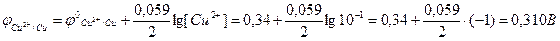
Оскільки  <
< 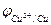 , то електрод з алюмінію є анодом, а з міді – катодом.
, то електрод з алюмінію є анодом, а з міді – катодом.
Схема ГЕ:
(Анод) Al | Al3+ || Cu2+ | Cu (Катод)
“–” “+”
На поверхні анода, тобто електрода з алюмінію, відбувається окиснення алюмінію (віддавання електронів атомами Al).
Рівняння анодного процесу:
Al – 3e– = Al3+ | 2
Електрони рухаються у зовнішньому колі від анода до катода. На поверхні катода, тобто електрода з міді, відбувається відновлення йонів купруму (приєднання електронів йонами Cu2+).
Рівняння катодного процесу:
Cu2+ + 2e– = Cu | 3
Рівняння сумарної, тобто струмоутворюючої реакції, одержуємо, складаючи рівняння електродних процесів, попередньо помноживши рівняння анодного процесу на 2, а катодного процесу – на 3:
2Al + 3Cu2+ = 2Al3+ + 3Cu
а) Розрахуємо електрорушійну силу ГЕ (11.4):
Е = φкатода – φанода = φ Cu2+ | Cu – φ Al3+ | Al = 0,310 – (–1,719) = 2,029 В
б) Обчислимо зміну стандартної енергії Гіббса струмоутворюючої реакції ΔG0 за виразом (10.3), який за стандартних умов має такий вигляд:
ΔG0 = – nFE0 , (10.10)
де n – кількість електронів, що приймають участь у струмоутворюючій реакції, дорівнює 6 моль (2 моль атомів Al віддають 6 моль електронів, які приєднують 3 моль йонів Cu2+),
E0 – стандартна електрорушійна сила ГЕ, яка дорівнює різниці стандартних електродних потенціалів:
Е0 = φ0 Cu2+ | Cu – φ0 Al3+ | Al = 0,34 – (–1,66) = 2 В
Отже,
ΔG0= – nFE0 = – 6 моль · 96,5  · 2 В = – 1158 кДж.
· 2 В = – 1158 кДж.
в) Розрахуємо стандартну енергію Гіббса утворення йонів Cu2+, враховуючи, що ΔG0(Al)=0 та ΔG0(Cu)=0:
ΔG0 = 2·ΔG0(Al3+) – 3·ΔG0(Cu2+);

Приклад 2. Складіть схему гальванічного елемента (ГЕ), в якому здійснюється струмоутворююча реакція, що відповідає рівнянню:
Cr + Au3+ = Cr3+ + Au
Напишіть рівняння електродних процесів. Розрахуйте: а) стандартну електрорушійну силу ГЕ, використовуючи зміну стандартної енергії Гіббса струмоутворюючої реакції, якщо відомі стандартні енергії Гіббса утворення йонів: ΔG0(Cr3+)= – 208 кДж/моль, ΔG0(Au3+)= 411 кДж/моль; б) концентрацію йонів Au3+, якщо коцентрація йонів Cr3+ становить 10-3 моль/л, а електрорушійна сила ГЕ дорівнює 2,071 В.
Розв’язання. Виходячи з рівняння наведеної в умові струмоутворюючої реакції, можна зробити висновок, що ГЕ утворений з двох металічних електродів, занурених у розчини своїх солей: один електрод – пластина хрому, а інший – пластина золота.
Оскільки φ0 Cr3+ | Cr < φ0 Au3+ | Au (Табл. Д.6), то анодом є пластина хрому, а катодом – пластина золота.
Складаємо схему ГЕ:
(Анод) Cr | Cr3+ || Au3+ | Au (Катод)
“–” “+”
Електрони рухаються у зовнішньому колі від анода, на якому відбувається окиснення атомів хрому, до катода, на якому відбувається відновлення йонів Au3+. Запишемо рівняння електродних процесів.
Рівняння анодного процесу:
Cr – 3e– = Cr3+ | 1
Рівняння катодного процесу:
Au3+ + 3e– = Au | 1
Складаємо рівняння електродних процесів і одержуємо рівняння струмоутворюючої реакції, яке збігається з наведеним в умові:
Cr + Au3+ = Cr3+ + Au
а) Розрахуємо зміну стандартної енергії Гіббса струмоутворюючої реакції, використовуючи стандартні енергії Гіббса утворення йонів Cr3+ та Au3+ і враховуючи, що ΔG0(Au)=0 та ΔG0(Cr)=0:
ΔG0 = ΔG0(Cr3+) – ΔG0(Au3+) =
= 1 моль·(–208 кДж/моль) – 1 моль·411 кДж/моль) = – 619 кДж
Стандартну електрорушійну силу ГЕ обчислимо за виразом (10.10), де n = 3 моль електронів, оскільки 1 моль атомів хрому віддає 3 моль електронів і цю кількість електронів приєднує 1 моль йонів Au3+.
ΔG0= – nFE0, 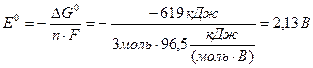
б) За рівнянням Нернста для металічних електродів (10.6) розрахуємо електродний потенціал пластини хрому:

Електродний потенціал пластини золота дорівнює:
Е = φкатода – φанода = φ Au3+ | Au – φ Cr3+ | Cr
φ Au3+ | Au = Е + φ Cr3+ | Cr =2,071+ (– 0,769) = 1,302 В
Виходячи з рівняння Нернста (10.6), обчислюємо концентрацію йонів Au3+ у розчині, в якому знаходиться пластина золота:
 ,
,
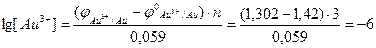
Отже, концентрація йонів Au3+ у розчині дорівнює: 
Приклад 3. Гальванічний елемент (ГЕ) складається зі срібної пластини, зануреної у розчин солі з концентрацією йонів Ag+ 10–5 моль/л, та водневого електрода з концентрацією йонів Н+ 0,01 моль/л. Наведіть схему ГЕ, запишіть рівняння електродних процесів та струмоутворюючої реакції. Розрахуйте електрорушійну силу ГЕ.
Розв’язання. Розрахуємо за рівняннями Нернста (10.6) та (10.7) потенціал срібного та водневого електродів:
 ,
,
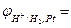 0,059lg[H+] = 0,059·lg10–2 = – 0,118 В
0,059lg[H+] = 0,059·lg10–2 = – 0,118 В
Оскільки  <
<  , то водневий електрод є анодом, а срібний – катодом.
, то водневий електрод є анодом, а срібний – катодом.
Схема ГЕ:
(Анод) Pt, H2 | H+ || Ag+ | Ag (Катод)
“–” “+”
На поверхні анода, тобто на поверхні платини, відбувається окиснення молекул водню.
Рівняння анодного процесу:
H2 – 2e- = 2H+ | 1
Електрони рухаються у зовнішньому колі від анода до катода. На поверхні катода, тобто срібного електрода, відбувається відновлення йонів арґентуму.
Рівняння катодного процесу:
Ag+ + e- = Ag | 2
Рівняння струмоутворюючої реакції одержуємо, складаючи рівняння електродних процесів, попередньо помноживши рівняння катодного процесу на 2.
H2 + 2Ag+ = 2H+ + 2Ag
Розрахуємо електрорушійну силу ГЕ:
Е = φ катода – φ анода = φ Ag+ | Ag – φ H+ | H2, Pt = 0,505 – (–0,118) = 0,623 В
Приклад 4. Складіть схему гальванічного елемента (ГЕ), в якому анодом є пластина кобальту у розчині солі з концентрацією йонів Со2+ 10–4 моль/л, а катодом – водневий електрод, занурений у розчин сульфатної кислоти. Електрорушійна сила ГЕ дорівнює 0,221 В.
Напишіть рівняння електродних процесів та струмоутворюючої реакції. Розрахуйте: а) потенціал металічного електрода; б) потенціал водневого електрода; в) рН розчину сульфатної кислоти та коцентрацію йонів Н+ у розчині.
Розв’язання. Складаємо схему ГЕ:
(Анод) Co | Co2+ || Н+ | H2, Pt (Катод)
“–” “+”
На аноді відбувається окиснення атомів кобальту. Електрони рухаються у зовнішньому колі до катода, на якому відбувається відновлення йонів гідрогену.
Рівняння анодного процесу:
Со – 2e- = Со | 1
Рівняння катодного процесу:
2H+ + 2e- = H2 | 1
Складаючи рівняння анодного та катодного процесів, одержуємо рівняння струмоутворюючої реакції:
Со + 2H+ = Со2+ + H2
Розрахуємо:
а) потенціал кобальтового електрода за рівнянням Нернста для металічних електродів (10.6):
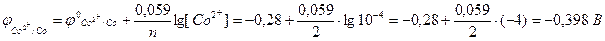
б) потенціал водневого електрода:
Е = φ катода – φ анода = φ H+ | H2, Pt – φ Со2+ | Со,
φ H+ | H2, Pt = Е + φ Со2+ | Со = 0,221 + (–0,398) = – 0,177 В
в) рН розчину сульфатної кислоти за рівнянням Нернста для водневого електрода (10.8):
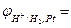 – 0,059рН
– 0,059рН

Враховуючи, що рН = –lg[H+], знаходимо концентрацію йонів гідрогену у розчині сульфатної кислоти (9.13):
[H+] = 10–рН=10-3 моль/л.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 4466; Нарушение авторских прав?; Мы поможем в написании вашей работы!