
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальні вказівки
|
|
|
|
КОМПЛЕКСНІ СПОЛУКИ
Лабораторна робота № 16
Питання для самоперевірки
Оформлення результатів роботи
Скласти рівняння окисно-відновних реакцій взаємодії металів з кислотами, використовуючи метод електронного балансу. Зробити висновок щодо впливу активності металу, концентрації кислот та температури на глибину окисно-відновного процесу.
1. Як змінюються металічні властивості в групах і періодах періодичної системи елементів?
2. Які метали називаються 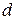 - елементами? Де вони знаходяться в періодичній системі?
- елементами? Де вони знаходяться в періодичній системі?
3. Чим відрізняється дія на метали соляної і розведеної сірчаної кислот від дії концентрованої сірчаної і азотної кислот?
Мета роботи - вивчення явища комплексоутворення, міцності комплексних іонів, а також поведінки комплексних сполук у хімічних реакціях.
Комплексні сполуки - це сполуки, здатні утворювати в твердому стані кристалічні решітки, у вузлах яких розміщуються комплексні іони, здатні існувати також у розчині.
Комплексними іонами називаються складні іони, що утворені з різних іонів і молекул, які мають властивості, що відрізняються від властивостей складових частин.
Атом (іон) металу (або неметалу), який приєднує до себе протилежно заряджені іони або молекули, утворюючи комплексний іон, називається комплексоутворювачем, або центральним атомом (іоном).
Протилежно заряджені іони, або молекули, які безпосередньо з ним сполучені, називаються адендами, або лігандами. Ліганди розміщуються навколо центрального іона по-різному залежно від координаційного числа.
Координаційним числом називають число хімічних зв’язків, якими іон-комплексоутворювач приєднує ліганди.
|
|
|
Щоб відрізнити прості іони від комплексних, під час написання формул комплексних сполук складні іони беруть у квадратні дужки.
Значення координаційного числа залежить, насамперед, від ступеня окиснення центрального іона. Найхарактерніші координаційні числа для центрального іона зі ступенями окиснення +1; +2; +3; +4 дорівнюють відповідно 2; 4 і 6; 6 і 4; 8.
Так, у комплексних сполуках Pt (1Y), Cr (Ш), Co (Ш), Fe (Ш) найчастіше координаційне число дорівнює 6; у комплексних сполуках Сu (П) – 4 та 6; Zn, Pb (П), Pt (П) – 4; у комплексних сполуках Ag (1), Cu (1), Au (1) – 2. Ці координаційні числа відповідають максимальному насиченню координаційної сфери (координаційно насичені сполуки). Залежно від умов можуть утворюватися також координаційно ненасичені комплексні сполуки. Так, крім комплексного іона 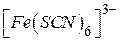 залежно від концентрації
залежно від концентрації 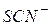 - іонів можуть утворюватися координаційно ненасичені комплексні іони та групи складу:
- іонів можуть утворюватися координаційно ненасичені комплексні іони та групи складу: 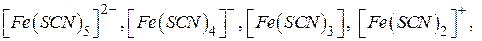
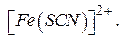
Заряд комплексного іона дорівнює алгебраїчній сумі зарядів простих іонів, що входять до його складу. На величину заряду комплексного іона не впливають електронейтральні молекули, що входять до його складу, наприклад:
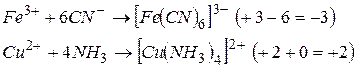
Серед зовнішніх ознак комплексоутворення слід виділити такі: 1) зменшення кількості вільних іонів; 2) зменшення ступеня гідролізу; 3) зміна забарвлення; 4) зміна природи електроліту; 5) зміна розчинності компонентів системи.
Назви комплексних сполук складаються з грецького числівника, яким позначають число лігандів; назви лігандів 
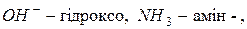 аніони називають, додаючи до їхньої латинської назви закінчення “о”, в абетковому порядку); потім нейтральні ліганди (вода - аква); назви іона – комплексоутворювача, використовуючи корінь його латинської назви і закінчення “-ат”; після чого римськими цифрами зазначають ступінь окиснення іона – комплексоутворювача. Після позначення складу внутрішньої сфери комплексної сполуки називають катіони зовнішньої сфери.
аніони називають, додаючи до їхньої латинської назви закінчення “о”, в абетковому порядку); потім нейтральні ліганди (вода - аква); назви іона – комплексоутворювача, використовуючи корінь його латинської назви і закінчення “-ат”; після чого римськими цифрами зазначають ступінь окиснення іона – комплексоутворювача. Після позначення складу внутрішньої сфери комплексної сполуки називають катіони зовнішньої сфери.
|
|
|
Наприклад:
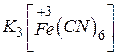 - гексаціаноферат(Ш) калію
- гексаціаноферат(Ш) калію
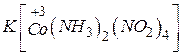 - тетранітродіамінкобальтат(Ш) калію
- тетранітродіамінкобальтат(Ш) калію
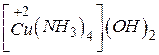 - гідроксид тетраамінкупруму(П)
- гідроксид тетраамінкупруму(П)
Комплексні сполуки в розчині дисоціюють на комплексний іон та зовнішню сферу:
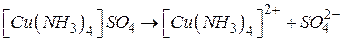
Ця дисоціація називається первинною. Оборотний розпад внутрішньої сфери комплексної сполуки називається вторинною дисоціацією:
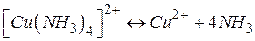
Константа дисоціації комплексного іону називається константою нестійкості:
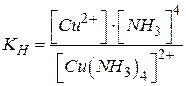
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 295; Нарушение авторских прав?; Мы поможем в написании вашей работы!