
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теорії кислот та основ
|
|
|
|
Значення рН деяких фізіологічних рідин організму
| Фізіологічна рідина | Значення рН | Можливі коливання |
| Шлунковий сік | 1,65 | 0,9 – 2,0 |
| Сеча | 5,8 | 5,0 – 6,5 |
| Слина | 6,75 | 5,6 – 7,9 |
| Жовч | 7,35 | 6,2 – 8,5 |
| Плазма крові | 7,36 | 7,25 – 7,44 |
| Спинномозкова рідина | 7,6 | 7,35 – 7,80 |
| Підшлунковий сік | 8,8 | 8,6 – 9,0 |
Від кислотності середовища залежить фармакологічна дія деяких лікарських препаратів. Тому препарати, які руйнуються під дією кислоти шлункового соку, вміщують у капсули, які розчиняються тільки у слабколужному середовищі кишок.
Згідно з теорією електролітичної дисоціації, загальні властивості кислот зумовлені наявністю в розчинах надлишку йонів Н+, а основ – йонів ОН-.. До окремої групи хімічних сполук входять амфотерні електроліти, тобто сполуки, що можуть дисоціювати як кислоти і як основи, наприклад Ве(ОН)2, Zn(OH)2.
Йонна теорія кислот і основ обмежується застосуванням її для водних розчинів.
Вчені Бренстед і Лоурі запропонували протолітичну (протонну) теорію, на основі якої кислотно – основні властивості речовин пояснюють за відношенням їх до протона.
Кислотою називають сполуку, що віддає протони, тобто є донором протонів:
HAn → H+ + An-
Основою називають сполуку, що приєднує протони, тобто є акцептором протонів:
B + H+ → BH+
Наприклад:

Електронна теорія кислот і основ Льюїса сформульована на основі електронної теорії будови молекул. Згідно з цією теорією, о снова – це речовина, що віддає вільні електронні пари для утворення октету, тобто є донором електронних пар;
кислота – це речовина, що використовує вільні пари електронів для утворення октету, тобто є акцептором електронної пари. Наприклад:

У хімії трапляються приклади, коли розчини різних середніх солей, що не містять ні йонів Гідрогену, ні гідроксид-іонів, виявляють кислотну або лужну реакцію середовища. Ці факти пояснюють процесом гідролізу, тобто взаємодією солі з водою. Характер перебігу реакцій гідролізу взагалі або солей, у вужчому розумінні слова, визначається природою цієї речовини.
|
|
|
Дія медичних препаратів, що належать до солей, зумовлена їх кислотно-основними властивостями, а саме здатністю до гідролізу в умовах фізіологічного середовища організму. Процеси гідролізу слід враховувати й під час зберігання медикаментів та їх призначення у комплексі з іншими лікарськими засобами.
Гідроліз солей. Гідролізом називають обмінну реакцію йонів солі з водою, що призводить до утворення слабких електролітів.
Будь-яку сіль KtAn можна уявити як продукт взаємодії кислоти і основи. Так, калій ціанід KCN утворений слабкою кислотою HCN і сильною основою КОН; амоній хлорид NH4C1 - слабкою основою NH4OH і сильною кислотою НС1, а натрій нітрат NaNО3 – сильною кислотою HNО3 і сильною основою NaOH. Тому солі за їх походженням і відношенням до води поділяють на чотири типи
1) Солі, утворені сильною основою і сильною кислотою, не зазнають гідролізу, оскільки йони цих солей не утворюють з водою слабких електролітів. Рівновага дисоціації води не порушується і концентрація йонів Н+ і ОН- залишається такою самою, як і в чистій воді. Отже, водний розчин солей такого типу матиме нейтральну реакцію (рН= 7):
NaCl + H2O → Na+ + Cl- + H+ + OH- ≠
2) Солі, утворені слабкою кислотою і сильною основою, гідролізують за аніоном і надають розчину лужної реакції:
Наприклад, розчин натрій ацетату СН3СООNa має лужну реакцію завдяки взаємодії аніона слабкої кислоти з водою:
CH3COONa + H2O → CH3COO- + Na+ + H+ + OH- → CH3COOH + Na+ + OH-
Середовище лужне, рН > 7 
За теорією Бренстеда - Лоурі, процес гідролізу пояснюють тим, що ацетат-іон СН3СОО- у водному розчині є слабкою основою, яка реагує з водою, тобто відбувається реакція протолізу – перенесення протона від молекули води до ацетат-іона.
|
|
|
3) Солі, утворені сильною кислотою і слабкою основою, гідролізують за катіоном і надають розчину кислотної реакції:.
Наприклад, амоній хлорид NH4C1 гідролізує за катіоном:
Kt+ + HOH  KtOH + H+
KtOH + H+
NH4Cl + H2O → NH4+ + Cl - + H+ + OH- → NH4OH + Cl- + H+
Середовище кисле, рН < 7
4) Солі, утворені слабкою кислотою і слабкою основою, гідролізують повністю з утворенням двох малодисоційованих або малорозчинних електролітів
Наприклад, амоній ацетат CH3COONH4 унаслідок гідролізу утворює слабку оцтову кислоту і слабку основу NH4OH, оскільки обидва йони солі одночасно зв’язують продукти дисоціації води (йони Н+ і ОН-), зміщуючи рівновагу вправо:
CH3COONH4 + H2O → CH3COO- + NH4+ + H+ + OH- → CH3COOH + NH4OH
Середовище нейтральне, рН = 7 
У зв’язку з тим, що константи дисоціації продуктів гідролізу майже однакові, розчин цієї солі буде практично нейтральним.
Кількісні характеристики гідролізу. Для кількісної оцінки гідролізу солей, який належить до оборотних реакцій, використовують поняття про ступінь гідролізу h та константу гідролізу КГ.
Ступінь гідролізу – це відношення числа гідролізованих молекул до їх загальної кількості в розчині, або відношення концентрації гідролізованої речовини до її загальної концентрації:
h = ∙100%
Ступінь гідролізу зростає зі зменшеннямконцентрації солі в розчині. Крім того, що слабкішою є кислота (основа), яка утворюється внаслідок гідролізу, то більшою мірою гідролізує ця сіль.
Якщо до розчину солі, що підлягає гідролізу, додати речовину, здатну зв’язувати продукти гідролізу, то рівновага зміститься вправо (посилення гідролізу). При додаванні однойменних йонів рівновага зміщується вліво. Це використовують за потреби призупинити гідроліз із метою подовження терміну зберігання деяких лікарських засобів з групи солей органічних кислот або основ.
Рівновагу процесу гідролізу можна також зміщувати, змінюючи температуру. Оскільки процес гідролізу є ендотермічним, то з підвищенням температури гідроліз солей посилюється.
Солі слабких трьохосновних кислот, наприклад ортофосфатної кислоти.
|
|
|
К3РО4, Na3PО4), гідролізують у дві стадії:
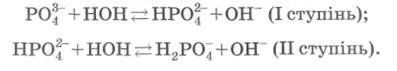
Гідроліз кислих солей карбонатної і фосфатної кислот має велике значення в біохімії, оскільки ці солі є компонентами буферних систем крові. Крім того, натрій гідрогенкарбонат NaHCО3 використовують як лікарський препарат.
Гідроліз деяких біологічно активних речовин. Гідроліз відіграє важливу і роль в обміні речовин. Основні продукти харчування людини – вуглеводи, жири, білки – в організмі зазнають гідролізу під дією ферментів, які називають гідролазами. У молекулах біосубстратів розщеплюються певні хімічні зв’язки і| утворюються простіші продукти, які на наступних стадіях беруть участь у реакціях біосинтезу. Наприклад, складні вуглеводи (полі- та олігосахариди) внаслідок гідролізу перетворюються на моносахариди:
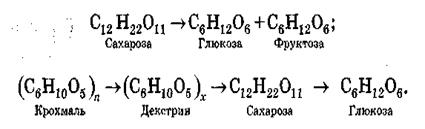
Оскільки жири (прості ліпіди) належать до естерів гліцерину та вищих жир-| них карбонових кислот, унаслідок їх гідролізу утворюються гліцерол і карбонові кислоти, що входили до їх складу.
Макромолекули білків під дією ферментів розщеплюються на амінокислоти, які беруть участь в утворенні білків, а частково гідролізують з утворенням карбонових кислот і амінів.
Для функціонування організму важливою є реакція гідролізу АТФ. Якщо молекулу АТФ умовно зобразити А – Р - Фн ~ ФН ~ ФН, де А –аденін, Р –рибоза, Фн – неорганічний фосфат, то процес гідролізу АТФ можна подати такою схемою:

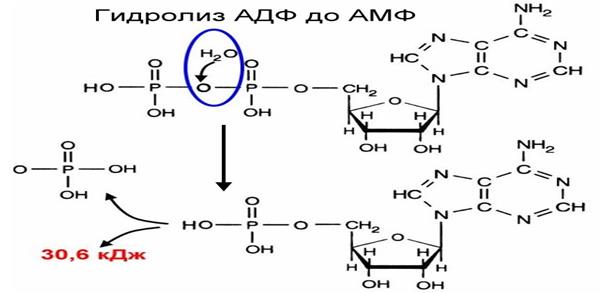
Таким чином, внаслідок послідовного розщеплення макроергічних зв’язків
у молекулі АТФ виділяється енергія.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 3041; Нарушение авторских прав?; Мы поможем в написании вашей работы!