
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекули рухаються хаотично
|
|
|
|
До реальних газів не можна використовувати закони ідеальних газів. Але понижуючи тиск можна кожен газ привести до стану ідеального.
Закони ідеальних газів краще всоьго відображають поведінку тих газів, якінайбільш важко стискаються, наприклад водень, гелій, неон. А для легкозріджуючихся газів діоксиду вудлецю, діоксиду сірки, відхилення спостерігаються і при нормальному тиску.
Фактори, які впливають на відхилення від законів ідеальних газів: взаємне притягання молекул і існування власного об’єму. Взаємне притягання послаблюється при збільшенні відстаней між молекулами, але при сильному зближенні молекул взаємне притягання досягає максимума. Потім швидко послаблюється і переходить у відштовхування. Для газів, що знаходяться при сталому зовнішньому тиску, взаємне притягання молекул призводить до до зменшенню об’є му, що займає газ. А наявність власного об’єму молекул зменшує простір між ними і відповідно зменшує довжину вільного пробігу молекул.
Ці фактори враховує рівняння стану реального назу ─ рівняння ван-дер-Ваальса:
 .величина a/V2 виражає поправку, що враховує взаємне притягання молекул, яке діє як деякий тиск К=а/V2, який стискує газ. Його називають внутрішнім тиском. величина b виражає поправку, що враховує власний об’єм молекул і взаємне відштовхування між ними. Величини а і b залежать від температури і тиску. В межах достатньо великих об”ємів ці члени втрачають своє значення і дане рівняння переходить в рівняння стану ідеального газу: pV=nRT
.величина a/V2 виражає поправку, що враховує взаємне притягання молекул, яке діє як деякий тиск К=а/V2, який стискує газ. Його називають внутрішнім тиском. величина b виражає поправку, що враховує власний об’єм молекул і взаємне відштовхування між ними. Величини а і b залежать від температури і тиску. В межах достатньо великих об”ємів ці члени втрачають своє значення і дане рівняння переходить в рівняння стану ідеального газу: pV=nRT
Ф.Х.
13.Фазові переходи індивідуальних речовин першого та другого роду.Термодинаміка фазових переходів.
До фазових переходів індивідуальних речовин першого роду належать:
|
|
|
агрегатні перетворення речовин(плавлення,випаровування,конденсації,сублімації ітд.)Для них характерні 3 ознаки:
1.перетворення індивідуальних речовин супроводжується стрибкоподібною зміною об’єму.
V1≠V2; V≠0
2.стрипкоподібною зміною мольної або питомої ентропії.
S1 ≠S2; S≠0
3.характеризується рівністю ізобарно-ізотермічного потенціалів речовини в стані динамічної рівноваги,тобто
G1=G2; G=0
Наприклад: лід- вода -пара.
Фазові перетворення інд. речовин другого роду,характеризуються слідуючими 3-ма ознаками:
1.рівністю об’ємів обох фаз речовини
V1=V2; V=0
2.сталістю величини мольної або питомої ентропії
S1 =S2; S=0
3.рівністю ізобарно-ізотермічного потенціалу в стані рівноваги
G1=G2; G=0
До таких перетворень належать перетворення всередині однієї фази.
Наприклад:перетворення феромагнітних властивостей в діамагнітні,вище точки Кюрі,сюди ж належать виникнення надпровідності в металах при наближенні до абсолютного нуля.
Розглянемо с-му лід-вода при сталому Р(тиску). Фазове перетворення індивідуальних речовин 1-го роду,характеризується зміною ізобарно-ізотермічного потенціалу.
ля першої фази зміна становитиме
dG1 =-SdT+Vdp
для 2-гої
dG2=-SdT+Vdp
так як в момент рівноваги dG1= dG2,прирівнявши праві іліві частини одержуємо: S=dT(V1-V2)dp(3)
Згідно2-го закону термодинаміки S=Q ∕T=λ∕T(4)
Q-прихована теплота фазового переходу
λ –мольна прихована теплота фазового перетворення.Вираз 4 підставимо у вираз 3,звідки одержимо:
λ=T(V1-V2)dp∕dt-р-ня Клапейрона-Клаузіуса для 1-го моля речовини.
Так як λ∕М=L-питома прихована теплота фазового перетворення.
L=T(V2-V1)∕M ·dp∕dt-р-ня клапейрона-Клаузіуса для 1-го грама речовини.
Ф.Х.
14.Застосування рівняння Клапейрона-Клаузіуса до процесів плавлення та випаровування.
Розглянемо с-му тверда фаза-рыдка фаза
λ=T(V1-V2)dp∕dt. На процес плавлення завжди затрачається тепло ззовні,тому мольна прихована теплота плавлення- λ,завжди буде величина додатня. Тпл.-величина додатня.Для більшості речовин V рідк.фази > вихідної твердої,тоді різниця цих об’ємів також додатня (V1-V2>0).Це означає,що dp∕dt також > 0
|
|
|
Отже,по мірі збільшення зовні.P величина Тпл.індив.речовини теж зростає.
Проте,для леяких р-н:води і тд.V2<V1,тоді dp∕dt є величина негативна і при збільшенні зовн.Р, знижуєт.Тпл.,дане явище х-не для Вісмуту,Галію,деяких сортів чавуну.
Для п-цесів випаровування х-на с-ма, рідка фаза-пара.На процес випаровування теж затрачається теплота ззовні,тому λ>0, Ткип.теж додатня,так як Vпари завжди > від Vвих.рідини,то V2-V1>0.Отже по мірі збільшення зовн.Р,Ткип.завжди зростає.
При температурах набаг. вищих від Ткип. Рідини реальна пара переходить в ідеальний газ,тобто V2>>V1,тому початковим об’ємом можна знехтувати.Тоді λвип.=TV2dp∕dt.,де V2 – об’єм газоподібної фази.
Λвип=RT2∕P · dp∕dt-р-ня Клапейрона-Клаузіуса для процесу випаровув. 1-го моля індивід. р-вини.
Ф.Х.
15.Основні поняття:фаза,компонент,ступінь вільності.Правило фаз Гіббса.Однокомпонентні системи.
Рівновага в складних гетерогеннихб с-мах, що містять багато фаз з певною кількістю індив.компонентів,описується основним принципом систематизації гетерогенних рівноваг «Правилом фаз Гіббса».До нього входять слідуючі основні поняття:
1.Кількість компонентів k(K)-число індивідуальних речовин,зменшених на число умов,якими вони зв’язані у с-мі.
-якщо в наявності фізична с-ма,то k=∑індивід.речовин.
-в хімічній с-мі k=∑індивід.речовин-∑хім.р-цій.
2.Фаза f(Ф)-це частина с-ми з однаковими фізичними та хімічними властивостями,яка відокремлюється від інших частин с-ми видимою поверхнею і яка може бути виділена з с-ми фізичними або хім.. методами.
Фази бувають прості,з 1-го компонента;складні з 2-ох і більше компонентів.
3.Число термодинамічних ступеней вільності S(С)-це число умов,або зовнішніх параметрів(Р,Т,С) які можна довільно змінювати в певних межах не порушуючи при цьому рівноваги с-ми,тобто не змінюючи кількості фаз у ній.
В рівноважній гетерогенній с-мі на яку із зовн.умов впливають тільки Р і Т,число S дорівнює числу компонентів збільшених на 2 і зменшених на число фаз у ній. S=k+2-f -прав.фаз Гіббса
|
|
|
Якщо крім Р і Т діє ще зовн.магнітне поле,то. S=k+3-f
Застосувавши правило Фаз Гіббса до однокомпонентних с-м: S=k+2-f,оскільки k=1,то. S=3-f,це означає,що в с-мі не може одночасно перебувати більше 3-ох фаз.
Якщо f=3: то S=0,це означає,не можна більше змінити жоден параметр,щоб не вплинути на рівновагу с-ми.Така с-ма наз.нонваріантна.
Якщо f=2: то S=1,можна змінювати тільки один параметр(Т або Р).С-ма моноваріантна.
Якщо f=1: то S=2,можна змінювати в певному інтервалі одночасно2 параметри(Р і Т).С-ма диваріантна.
Ф.Х.
17.Виникнення електродного потенціалу на межі розділу метал-розчин його солі.Фактори,що впливають на величину електродного потенціалу.Рівняння Нернста.
Якщо пластинку з будь-якого металу занурити у воду або в розчин електроліту,що містить іони цього ж металу,то дуже невелика,але завжди вимірювана частина металу перейде в розчин у формі додатньо заряджених іонів,а сама пластина,концентруючи на собі надлишок вільних електронів,набуває відємного заряду.Такому переходу сприяє зв’язування металу з молекулами води(розчинника).Як наслідок встановлюється рівновага.
МеóМеz+ + ze-
Меz++ mH2Oó Меz+ · mH2O
Me + mH2Oó Меz++ mH2O + ze-
Додатньо заряджені іони металу,що перейшли в розчин,концентруються біля поверхні пластини,яка набуває відємного заряду,і внаслідок виникає так званий подвійний електричний шар,який обумовлює різкий стрибок потенціалу на межі розділу метал-розчин електроліту.
Різницю електричних потенціалів E,або стрибок потенціалу на межі метал-розчин електроліта,прийнято називати електродним потенціалом і позначати Е,його величина виірюється згідно р-нню Ернста.
Ем еz+∕ м е= Е0м еz+∕ м е + RT∕zF ln а меz+,де F-стала Фарадея; z- заряд іона металу; аме z+-активність іонів металу в р-ні, кмоль∕м3; Ем еz+∕ м е- стандартний потенціал при активності іонів металу,рівний 1 кмоль∕м3.
Електродний потенціал залежить від: природи металу, природи розчинника, активності іонів металу в р-ні, температури.
Ф.Х.
|
|
|
22.Дисперсні системи, основні поняття.Класифікація дисперсних с-м.
Дисперсійною фазою назив.- подрібнену речовину,частинки якої рівномірно розподілені в масі іншої речовини,а середовище в якому вона розподілена- дисперсійним середовищем.
-В залежності від величини розмір
ів частинок дисперсні с-ми (ДС) розподіляються на типи:
1. грубодисперсні (грубі зависі,суспензії,емульсії,порошки) з радіусом частинок 10-4 -10-7м (мікроскопічна дисперсність).
2. колоїдно-дисперсні (золі) з розмірами частинок 10-7-10-9м (колоїдна дисперсність)-це колоїдні р-ни.
3 .молекулярні та іонні розчини з розміром частинок менше 10-9 м (10-9-10-10м молек.дисперсн.;…10-10м іонна дисперсність)-істинні р-ни.
-В залеж. Від агрегатного стану ДФ та ДС:
т∕г- табачний дим;пил цементу,цукру,муки тощо.
т∕р- суспензії;холодне молоко;золі:колоїдні р-ни металів ітд.
т∕т- металічні сплави;штучні дрогоцінні камені,кольорове скло.
р∕г- аерозолі;туман,хмари.
р∕р- емульсії;гаряче молоко,маргарин:емульсії масла у воді, води у нафті.
р∕т- природні мінерали з рідкими включеннями:перли,опал тощо.
г∕г- гомогенні суміші (не є ДС)
г∕р- піни:на пиві тощо.
г∕т- тверді піни: пінопласт, пемза, активоване вугілля.
Ф.Х.
23.Методи одержання колоїдних розчинів.будова міцели ліофобного золю.
1.одержання колоїдних р-нів шляхом укрупнення частинок при агрегації молекул або іонів у більш великі частки (конденсаційні методи).
2.шляхом роздроблення,або диспергування великих частинок на більш дрібні(дисперсійні м-ди).
До конденсаційних методів відносять:
-м-ди хім..конденсації(коли при хім. реакції утвор. нова фаза,що нерозчинна в даному середовищі).
а) р-ції відновлення.Наприклад,золь метал.срібла можна одержати відновленням розведеного р-ну нітрата аргентума формальдегідом у лужн.сер.Будова міцели оержаного золю: {m[Ag]·mAgO·nAgO-(n-x)K+}x-·xK+.
б) р-ції окислення.наприклад,одержання золю сірки.2H2S+O2=2H2O+2S. В в р-ні утв.блакитний колоїдний р-н елементної S.
в) р-ції подвійного обміну.наприклад,при змішуванні розведених р-нів нітрату барію з сульфатом натрію(в надлишку) осад сульфату барію,що утв.
Ba(NO3)2+Na2SO4=BaSO4+2NaNO3
переходить в колоїдний стан утворюючи міцелу:
{m[BaSO4]nSO2-4 2(n-x)Na+}2x-2xNa+
Принадлишку нітрату барію будова міцели буде така:
{m[BaSO4]nBa2+ 2(n-x)NO3-}2x-2xNO3-.
г)метод гідролізу.Здебільшого застосовують для одержання золів важких металів.наприклад,FeCl3+3H2O=Fe(OH)3+3HCl.
Одержуємо золь міцела якого має таку будову.
{m[Fe(OH)3]nFeO+ (n-x)Cl-}x+xCl-.
До дисперсійних методів відносять:
-механічне диспергування;
-пептизація або фізико-хім. диспергування(заснований на розєднанні злиплих частинок)
-ультразвукове диспергування;
-електричного розпилення(базується на розпиленні металів полум’ям електричної дуги, яка утворюється в розчині між металічними електродами).
Будь-який ліофобний(гідрофобний) колоїд. р-н склд.з 2-ох частин:міцел і інерміцелярної рідини.Міцели-це окремі колоїдні частинки,які в сукупності складають ДФ золю,а інтерміцелярна рідина-це ДС того ж золю,включаючи крім розчинника всі інші розчинені вньому речовини,які не входять в склад міцел.
Будова міцели на прикладі AgJ.
AgNO3+KJ=AgJ+KNO3
Для випадку,коли С AgNO3<С KJ
{[mAgJ] nJ-(n-x)K+}-xK+
| Потенціалвизначальні йони | Протиіони адсорб.шару | Проти іони дифуз.шару | |
| {[mAgJ] | nJ- | (n-x)K+}- | xK+ |
| Агрегат | Адсорбційний шар | Дифуз шар | |
| Ядро міцели | |||
| гранула Гранула | |||
| Міцела |
Ф.Х.
24.Коагуляція колоїдних розчинів електролітами. Поріг коагуляції. Правило Панета-Фаянса. Механізми коагуляції.
Зміна певних умов призводить до коагуляції золю. При введенні в р-н золю одночасно більше 1-го ел-ту може спостерігатися різна коагуляційна здатність.Н-д: при дод. суміші 2-х ел-тів спостер. таке явище як:
1. Адитивність Ссум= Сел1+Сел2; Ссум=70%КСl+30%NaCl
2. Синергізм Ссум< Cел1+Cел2 ; Cсум=70%LiCl+10%CsCl
3 .Антагонізм Ссум >Сел1+Сел2 Cсум=70%KlCl+50%CaCl2
Найменша к-сть ел-ту, яка викликає коагуляцію одиниці об’єму золю наз. порогом коагуляції (Ск.)
Ск=nел/Vзолю [Ск]=[моль/л].
Механізми коагуляції:
1. Мех.-м концентраційної коагуляції спостеріг-ся при дод. надл ПрВі міцели(дод іонів К+) або надл ПВІ(дод І-)
а) індиферентні іони (К+)
б) неіндиферентних іонів (І-) до золю.
{m[AgI]nI-(n-x)K+}-xx K+
Стійкість золю буде хар-ся наявністю заряду гранули, а відповідно і якомога більшою величиною ел. Хім.. пот-лу es.
2. Мех.-м нейтралізаційної коагуляції. Даний мех.-м спостер в-к повної нейтралізації ПВІ або індефер іонами з більшою валентністю(дод Fe3+, Al3+), або неіндеф іонів (дод Ag+).
Ф.Х.
25. Молекулярно-кінетичні та оптичні властивості ДС.
Харктерною властивістю вільнодисперсних систем є схильність до осідання або вспливання часточок. Осідання називається седиментацією, а вспливання─ зворотньою седиментацією. Здатність до седиментації виражають через константу седементації, яка для сферичних частинок рівна:

тобто константа седиментації залежить не лише від розмірів частинок, але і від природи фаз.
Наступною кінетичною (молекулярно-кінетичною) властивістю є броунівський рух. Природа даного руху була доказана Ейнштейном і Смолуховським, які вивели закон:квадрат зсуву пропорційний коефіцієнту дифузії і часу:
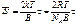 В─коефіцієнт тертя
В─коефіцієнт тертя
електроосмос (електрокінетична властивість)─ переміщення рідини в пористих тілах під дією електричного поля. Швидкість електроосмотичного руху описується рівнянням гальмгольца-Смолуховського:
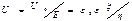 або
або 
Електрофорез─ переміщення частинок дисперсної фази в електричному полі.
Оптичні властивості золю визначаються властивостями колоїдних частинок, тому вивчаючи оптичні властивості системи, можна встановити розмір, форму і будову частонок, які не видно в звичайний мікроскоп.
При падінні променю світлана дисперсну систему можуть спостерігатись наступні явища:
1. Проходження світла через систему
2. Заломлювання світла часточками дисперсної фази
3. Відбивання світла частинками ДФ
4. Розсіювання світла (опалесценція)
5. Абсорбція (поглинання) світлу ДФ з перетворенням світлової енергії в теплову.
Розсіювання світла. Інтенсивність розсіяного світла в різних напрямках різна. Якщо частинки малі в порівнянні з довжиною хвилі, більше всьго світла розсіюється під кутом в 0 і 180˚ до променю падаючого на частинку. Якщо частинки великі (але менші ніж довжина світлової хвилі), максимальна кількість світла, що розсіюється в направлені падаючого променю. Крім того, розсіяне світло найчастіше поляризоване. При цьому для малих часточок світло, розсіяне під кутом в 0 і 180˚, поляризоване зовсім, а світло, що розсіяне під кутом 90˚, поляризоване повністю, для великих часточок максимальна поляризація спостерігається при куті, що відрізняється від 90˚.
Для сферичних частинок малих по відношенню до довжини хвилі було виведено рівняння (рівняння Реллея):
 дане рівняння
дане рівняння
n1 i n0─ показники заломлення дисперсної фази і дисперсного середовища, ν─ чисельна концентрація,V─ об”єм однієї частинки, λ─довжина хвилі.
застосовують, коли розмір частинок складає не більше 0,1 довжини хвилі. При збільшенні частинок більше визначеного розміру відбивання світла від часточок збільшується, що призводить до зменшення інтенсивності розсіяного світла. Розом з цим по мірі зменшення частинок інтенсивність світлорозсіювання також падає. Тому максимальним світлорозсіюванням володіють колоїдні системи.
Абсорбція світла. Закон поглинання світла Бугера-Ламберта-Бера: ln(I0/In)=εCl, що був виведений для гомогених систем, можна застосовувати і для золей високої дисперсності, при умові невеликого шару рідини. але металеві золі у відношені абсорбції проявляють аномальну поведінку в порівнянні з іншими колоїдними розчинами. Таму для металевих золей рівняння світлопоглинання повинно враховувати дисперсність:
In=I0exp[─εCl/f(r3)], але при рості дисперсності часточки стають настількт малі, що вже не заважають проходженю світла, і цьому випадку поводять себе як істинні розчини.
Оптичними методами досл є:
1. Ультрамікроскопія. Відрізняється від звичайної мікроскопії тим, що при спостереженні кол р-ну в-к пропускання пучка променів світла, сам фон(кол р-н) буде темним, а кол част-ки(ДФ) будуть світитися.
2.Нефелометрія- ґрунтується на порівнянні розсіюваного світла стандартного р-ну(чисте ДС-ще) та його розсіюв у досліджуваному кол р-ні.. Описується р-ням Бугера- Ламберта- Бера: Ір=Іо-kd d- товщина кювети; k- константа, яка залеж від ф-рів розсіювання.
3. Турбідиметрія.- м-д кількісного хім. аналізу, заснований на вимірюванні інтенсивності світла, поглиненого зваженими частинками середовища.
Ф.Х.
18. Гальванічні елементи
Гальванічні елементи являють собою електролітичну вану, в яку занурені два металеві електроди в розчини відповідних їм солей, які з”єднані між собою.
Якщо в посудину з водою занурити метал, то молекули води стають до нього таким чином, що можуть витягувати йони металу. Метал несе на собі негативний заряд. Утворюється подвійний електричний шар, наявність якого дає можливість виникати стрибку потенціалу. Цей потенціал, який виникає на межі метал─розчин називається електродним потенціалом. Така властивість називається електролітичною пружністю розчинника (Р). Але кожний розчин має певне значення осмотичного тиску (Р0). В залежності від співвідношення цих величин може йти або розчинення металу, або навпаки відкладання металу на електроді:
Р>Р0, то йде процес розчинення
Р<Р0, то йде відкладання металу на електроді
Р=Р0 ─не утворюється подвійной електричний шар.
Любий гальванічний елемент кількісно характеризується електрорушійною силою (е.р.с.), під якою розуміють різницю електродних потенціалів. Наприклад е.р.с.мідно-цинкового гальванічного елемента дорівнює різниці потенціалів мідного і цинкового електродів:
 не існує методу визначення електродного потенціалу, визначають по відношенню до якогось електрода, потенціал якого відомий.
не існує методу визначення електродного потенціалу, визначають по відношенню до якогось електрода, потенціал якого відомий.
Нернст запропонував рівняння, яке дає можливість обрахувати величину електродного потенціалу: 
 , де П0─ стандартне значення потенціалу.
, де П0─ стандартне значення потенціалу.
Розрізняють наступні типи гальванічних елементів:
1. окисно-відновні
2. хімічні
3. зворотні і не зворотні
4. концентраційні.
Окисно-відновні ─в яких проходить процес ок-ня і від-ня.
Хімічні─ протікають хімічні процеси
Мідно-цинковий гальванічний елемент відноситься як до хімічних так і до окисно-відновних.
Гальванічний елемент буде зворотнім, якщо для нього створити умови, при яких внутрі гальванічного елементу будуть проходити процеси у зворотньому напрямку. До незворотніх відносять гальванічні елементи в процесі роботи яки виділяється малодисоційовна речовина (вода), випадає осад, відбувається виділення газу.
Концентраційні─ такі елементи, які побудовані з двох електродів идного металу і занурені врозчини солі цього металу різних концентрацій.
Ф.Х.
16. Застосування правила фаз Гіббса. Двокомпонентні системи. Діаграми стану двокомпонентних систем.
Правило фаз Гібса основане на другому законі термодинаміки і відноситься до систем, що знаходяться в стані рівноваги. Число ступенів волі рівноважної термодинамічної системи, на яку із зовнішніх факторів впливають тільки температура і тиск, дорівнює числу незалежних компонентів системи мінус число фаз плюс два.
С=К─Ф+2. Число ступенів волі (С) визначається як число умов, які можна змінити, не змінюючи цим числа фаз системи.
При класифікації систем прийнято розрізняти їх за кількістю фаз на однофазні, двуфазні і трифазні і т.д., за кількістю незалежних компонентів системи на однокомпонентні, двокомпонентні і трьохкомпонентні.
Застосування пр. ф. Гіббса до двохкомпонентних систем свідчить, що:
S = k + 2 – f; Так, як k = 2
S = 2 + 2 – f = 4 – f (одночасно можуть існувати 4 фази)
Кількість параметрів, що характеризує дану систему: C1, C2, P, T. Так, як C2 = 100% - C1, залишаються 3 параметри: C1, P, T.
1-й тип діаграми стану (коли A і B необмежено розчинна у рідкому стані, а в твердому не утворює.)
- вище кривих L існує тільки рідка фаза
- нижче S – існує тільки тверда фаза
E – т. нон варіантної рівноваги,
т. евтектики(в ній існують 4 фази)
1. розплав A і B
2. розплав + тверді кристали компонента A
3. розплав + тверді кристали компонента B
4. механічна суміш твердих кристалів A і B
2-й тип діаграми стану (коли компоненти A і B мають необмежену розчинність і в рідкому і в тв. стані)
Наприклад: Pb-Ni; Fe-Ni; Ag-Au
1. рідка фаза (розплав A і B)
2. розплав (тв. реч.)
3. тв. фаза (тв.реч.)
Ф.Х.
20.Каталітичні процеси. Явище каталізу.Види каталізу. Промотори та інгібітори. Їх застосування в промислових процесах.
Берцеліус в 1836 р. вперше ввів поняття «каталіз»,визначив каталіз, як силу під дією якої відбувається це явище. Це викликало заперечення з боку ряду відомих вчених того часу (Лібіх, Фарадей), які не були згідні з визначенням Берцеліуса
-тому, що явище каталізу повязувалося з існуванням якоїсь особливої таємничої сили
-неправильним є твердження про те, що каталізатор може викликати реа., які без нього не відбуваються.
Вільгельм довів, що каталізатор не викликає, а тільки прискорює реа. Оствальд додав кат.- це така реч., яка не входячи в кінцевий продукт, змінює її швидкість.
Сьогодні: кат- це прискорення хімічної реа. Речовиною або тілом,яке бере участь у тій чи ін. елементарній стадії реа.,але щоразу виходить з цієї стадії хімічно незмінним.
Всі явища каталізу поділяють на дві вел. групи: 1.гомогенний 2. гетерогенний
До гомог. каталізу належать процеси, що протікають в системах, в яких кат. Рівномірно розподілений у реакційному об’ємі. Приклади: інверсія тростинового цукру, гідроліз крохмалю, сульфування,гідратація,…
Гетерог.- об’єднує проц., що відбув. на тв.(іноді рідких) кат. Дн реагуючі речовини і кат. Розділені поверхнею останнього.
Є ще одна менша група – мікро генний каталіз.(пероксид водню і ін. реч у присутності колоїдної пластинки) Перший і другий відрізняються: у гомог.- реа прот. у
Ф.Х.
12.Робота різних процесів для одного моля ідеального газу.
Будь-яку величину роботи можна представити як добуток двох величин: фактора ємності та фактора інтенсивності: А=Фємн•Фінт, А=p•∆V
Розглядаємо процес при: 1)ізохорний V=const, 2)ізобарний P=const, 3)ізотермічний T=const, 4)адіабатичний процес Q=0.
1)ізохорний процес V=const
Згідно з 1 законом термодинаміки dU=δQ−δA, δQ=dU+δA, δQ=dU+pdV, Q=∆U+A, Q=∆U+p∆V, Q=C∆T+p∆V, δA=pdV
Так як V=const, тоді ∆V=0, p∆V=0, тоді А=0. Отже А=v1∫v2pdV=0
2)ізобарний процес P=const
δQ=dU+δA, δQ=dU+pdV, δA=pdV, А=v1∫v2pdV, А=p(V2−V1)-для одного моля ідеального газу
А=рV2−рV1. Згідно з рівнянням Менделєєв – Клапейрона для одного моля ідеального газу: pV=RT, тоді A=R(T2−T1)
3)ізотермічний процес T=const
δQ=dU+δA, δQ=dU+pdV, δA=pdV, А=∫pdV. Згідно з рівнянням Менделєєв – Клапейрона для одного моля ідеального газу: pV=RT, тоді p=RT/V, А=v1∫v2RTdV/V=RTv1∫v2dV/V=RTlnV2/V1, A=RTlnV2/V1
4)адіабатичний процес Q=0,
δQ=dU+δA, δA=−dU, A=−∫dU=−T1∫T2CvdT=−CvT1∫T2dT=−Cv(T2−T1)=Cv(T1−T2), A=Cv(T1−T2)
так як Cp-Cv=R i Cp/Cv=k тому A=R(T1-T2)/k-1, A=RT1-RT2/k-1, Згідно з рівнянням Менделєєв – Клапейрона для одного моля ідеального газу: pV=RT, тоді A=P1V1-P2V2/k-1
Рівняння адіабат у них має значення: pVk=const; p1V1k=p2V2k ; TVk-1=const; T1V1k-1=T2V2k-1 ; Tkp1-k=const; T1kp11-k=T2kp21-k
Ф.Х.
7.Ентропія.М-ди розрахунку ентропії для різних процесів.Абсолютне значення ентропії.Постулат Планка.
Ентропія-це міра хаосу. Постулат Планка: Ентропія ідеально побудованого кристалічного тіла індивідуальної речовини або елемента дорівнює нулю при абсолютному нулі. dS=δQ/T=CpdT/T; ∆S=S−S0=∫δQdT/T=To∫TCpdT/T; To=0; S0=0; тоді S=o∫TCpdT/T − абсолютне значення ентропії. Для реальних речовин S0>0. Абсолютне значення ентропії, супроводжується фазовими переходами:
S=o∫TплCp(тв)dT/T+λпл /Тпл +Тпл ∫TкипCp(рід)dT/T+λвип /Ткип + Ткип∫TCp(газ)dT/T.
Методи розрахунку ентропії: dU=δQ−δA, δQ=dU+δA, δQ=dU+pdV, δQ=CvdТ+pdV. Згідно з 2 законом термодинаміки dS=δQ/T=CvdТ/T+pdV/T. Згідно з рівнянням Менделєєв – Клапейрона для одного моля ідеального газу: pV=RT, звідки p/T=R/V, тоді dS=CvdТ/T+RdV/V − для одного моля. Для n молів: dS=nCvdТ/T+nRdV/V.
1)ізобарний процес P=const dS=nCvdТ/T+nRdV/V
Проінтегруємо даний вираз s1∫s2dS=T1∫T2nCvdТ/T+v1∫v2nRdV/V=nCvlnT2/T1+nRlnV2/V1; ∆S=S2−S1 =nCvlnT2/T1+nRlnV2/V1−формула для розрахунку ентропії при P=const
2)ізохорний процес V=const. для одного моля ідеального газу: dS=CpdТ/T−Rdp/p; Для n молів: dS=nCpdТ/T−nRdp/p. Проінтегруємо даний вираз s1∫s2dS=T1∫T2nCpdТ/T−p1∫p2nRdp/p.
∆S=S2−S1 =nCplnT2/T1−nRlnp2/p1; ∆S=S2−S1 =nCplnT2/T1+nRlnp1/p2 −формула для розрахунку ентропії при V=const
3)ізотермічний процес T=const. для одного моля ідеального газу: dS=CpdV/V+Cvdp/p; Для n молів: dS=nCpdV/V+nCvdp/p. Проінтегруємо даний вираз s1∫s2dS=v1∫v2nCpdV/V+p1∫p2nCvdp/p; ∆S=S2−S1 =nCplnV2/V1+nCvlnp2/p1−формула для розрахунку ентропії при T=const
знаходження для фазового перетворення ∆S=ST−STo=To∫TплCp(тв)dT/T+λпл /Тпл +Тпл ∫TкипCp(рід)dT/T+λвип /Ткип + Ткип∫TCp(газ)dT/T
4)адіабатичний процес Q=0,
Оскільки Q=0 (відсутній теплообмін), тоді δQ=0. dS=δQ/T=0. Тобто s1∫s2dS=Q1∫Q2δQdT/T=0. Тобто ∆S=S2−S1 =0
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1446; Нарушение авторских прав?; Мы поможем в написании вашей работы!