
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 3. Будова атома і систематика хімічних елементів. До кінця ХІХ ст. атоми вважались неподільними
|
|
|
|
До кінця ХІХ ст. атоми вважались неподільними. Проте, протягом останнього десятиліття ХІХ ст. було встановлено ряд фактів, які свідчили про складну будову атомів і про можливість перетворень одних атомів в інші. Насамперед, це було відкриття електрона англійським фізиком Дж.Дж.Томсоном в 1897 р. і радіоактивності в 1896 р. французьким фізиком А.Беккерелєм.
Електрон – елементарна частинка, яка має найменший негативний електричний заряд, що існує в природі – 1,602.10-19 Кл. Заряд електрона був прийнятий за одиницю елементарного електричного заряду. В цих одиницях заряд електрона – 1. Маса електрона дорівнює 9,105.10-31 кг. Було встановлено, що електрони є в атомах усіх елементів. Але атоми електронейтральні, отже, в атомах мають бути ще і позитивно заряджені частинки.
З’являється перша модель атома, запропонована в 1903 р. Дж.Дж.Томсоном, згідно з якою атом складається з позитивно зарядженої сфери, в яку вкраплені від’ємні електрони. Однак, в 1911 р. Резерфорд на основі дослідів по розсіюванню α -частинок запропонував ядерну теорію будови атома. За цією теорією, подібно до того, як в сонячний системі навколо Сонця обертаються планети, так навколо ядра на різних відстанях обертаються електрони. Сумарний від’ємний заряд електронів чисельно дорівнює додатному заряду ядра. Маса електронів надзвичайно мала, тому майже вся маса атома зосереджена в його ядрі. Розміри ядра в десятки тисяч разів менші за розміри атома. Діаметр атома – величина порядку 10-8 см, а діаметр ядра – порядку 10-13 – 10-12 см.
Однак, планетарна модель Резерфорда протирічила факту стійкого існування атома. В результаті руху електрона по замкненій орбіті витрачається енергія його електростатичної взаємодії з ядром, і електрон, відповідно до розрахунків, через 10-8 с має впасти на ядро.
|
|
|
Згідно з моделлю Резерфорда енергія атома повинна зменшуватись безперервно за рахунок випромінювання, утворюючи суцільний спектр. Проте, експериментально встановлено, що всі атомні спектри мають дискретний (лінійчастий) характер.
Для пояснення особливостей спектрів нагрітих тіл німецьким вченим М.Планком (1900 р.) була запропонована теорія, заснована на припущенні, що енергія випромінюється окремими порціями-квантами, величина яких залежить від частоти випромінювання світла, а саме:
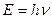 ,
,
де Е – енергія кванта, h - стала Планка, яка дорівнює 6,626.10-34 Дж . с, v - частота коливань, що дорівнює відношенню швидкості світла С до довжини хвилі λ.
Це рівняння називається рівнянням Планка. Випромінюючи квант світла, атом переходить з одного енергетичного стану в інший.
На основі моделі Резерфорда і квантової теорії випромінювання Планка даньським фізиком Нільсом Бором в 1913 р. була запропонована теорія будови атома Гідрогену. Ця теорія дозволила пояснити властивості атома і походження ліній спектра.
Бор припустив, що рух електрона в атомі обмежений індивідуальною стійкою орбітою. Поки електрон знаходиться на цій орбіті, він не випромінює енергії. Умова стійкості кругової орбіти з радіусом 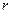 така:
така:
 ,
,  ,
,
де rn - радіус орбіти, на довжині якої укладається n довжин хвиль. Ціле число n одержало назву квантового числа. Підставивши значення λ (довжина хвилі електрона), можна визначити значення rn. Радіус найближчої до ядра орбіти атома Гідрогену називають Боровським радіусом і позначають a0. При цьому a0 = r1 = 0,053нм. Радіуси інших орбіт визначають з допомогою співвідношення rn = n2a0.
Різним дозволеним орбітам відповідають різні рівні енергії електрона. При переході електрона з верхнього рівня на нижчий виділяється енергія:
|
|
|
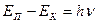 ,
,
де ЕП - енергія в початковому стані, ЕК - енергія в кінцевому стані, v - частота випромінювання, h - стала Планка.
Отже, при переході електрона з одного стану в інший виділяється енергія у вигляді випромінювання. Це пояснює походження атомних спектрів. Але теорія Бора виявилась неспроможною пояснити будову складних атомів і передбачити поведінку атома Гідрогену в магнітному полі. Виникла необхідність в розробці нової теорії для пояснення поведінки мікрочастинок, які не підпорядковуються законам макроскопічних тіл.
Такою теорією виявилась квантова, або хвильова механіка.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 484; Нарушение авторских прав?; Мы поможем в написании вашей работы!