
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Йонний зв’язок
|
|
|
|
Зв’язок такого типу утворюється внаслідок взаємного притягання протилежно заряджених йонів, утворених елементами, які значно відрізняються своєю електронегативністю.
Наприклад, під час взаємодії атомів Натрію (1 s 22 s 22 p 63 s 1) з атомами Хлору (1 s 22 s 22 p 63 s 23 р 5) відбувається перехід електрона з s -орбіталі атома Натрію на 3 р -орбіталь атома Хлору. При цьому атом Натрію перетворюється на позитивно заряджений йон зі стабільною конфігурацією найближчого інертного елемента – Неону (1 s 22 s 22 р 6). Атом Хлору приймає цей електрон на 3р-орбіталь і перетворюється на негативно заряджений йон з електронною конфігурацією 1 s 22 s 22 p 63 s 23 р 6, яка характерна для Аргону. Між протилежно зарядженими йонами виникають сили електростатичного притягання. Цей процес можна зобразити схемою:
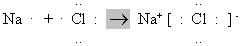
Йонний зв’язок не має напрямленості, тому що електричне поле йона характеризується сферичною симетрією, тобто зменшується з відстанню по одному і тому ж закону в будь-якому напрямку. Саме тому взаємодія між йонами відбувається однаково незалежно від напрямку.
Система з двох зарядів, однакових за абсолютним значенням, але протилежних за знаком, створює в навколишньому середовищі електричне поле. Це означає, що два різноманітних йони, які притягнулись один до одного, зберігають здатність електростатично взаємодіяти з іншими йонами. Тому йонний зв’язок не має насиченості. До будь-якого йона може приєднуватись різна кількість йонів протилежного знаку.
Відсутність у йонного з’язку напрямленості і насиченості зумовлює здатність йонних молекул до асоціації, тобто об’єднання.
Всі йонні сполуки в твердому стані мають йонну кристалічну гратку. Наприклад, для натрій хлориду вона має такий вигляд (рис. 19).
Утворення йонів О2-, S2-, N3- енергетично невигідне, тому в таких сполуках, як оксиди, сульфіди, нітриди (BaO, Al2O3, ZnS, Mg3N2) не утворюється „чисто” йонний зв’язок. Тут хімічний зв’язок має частково ковалентний характер.
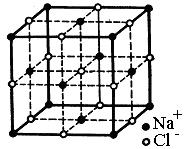
Рис. 19. Кристалічна гратка натрій хлориду
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 956; Нарушение авторских прав?; Мы поможем в написании вашей работы!