
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Напрямок перебігу хімічних реакцій
|
|
|
|
Здатність речовин до хімічної взаємодії називають хімічною спорідненістю. Мірою хімічної спорідненості є зміна вільної енергії Гіббса. Хімічна спорідненість визначається конкуруючим впливом ентальпійного (∆H) і ентропійного (T.∆S) чинників.
З рівняння ∆G = ∆H-T∆S випливає, що в залежності від співвідношення між ∆H і T∆S визначається знак зміни енергії Гіббса і можна встановити напрямок хімічних реакцій. Реакція самовільно відбувається в прямому напрямку, якщо ∆G<0 при Р=const і T=const. Зменшення енергії Гіббса супроводжується зростанням ентропійного (T∆S) і зменшенням ентальпійного (∆H) чинників.
Якщо ∆G>0 при P=const і T=const, то реакція в прямому напрямку самовільно не відбувається, тому що супроводжується збільшенням ентальпійного і зменшенням ентропійного чинників. Реакція можлива тільки в зворотному напрямку. Якщо ∆G=0 при P=const і T=const, то система знаходиться в стані рівноваги.
Можливі також три граничні випадки:
1. Т = 0; ∆S = 0 і (T∆S) = 0, тоді ∆G = ∆H. Реакція можлива при невисоких температурах, коли ∆H >> T∆S.
2. ∆H = 0, тоді ∆G =(-T∆S). Хімічна спорідненість визначається ентропійними змінами.
3. ∆G = 0, тоді ∆H = T∆S, що відповідає хімічній рівновазі.
Але для більшості процесів ентальпійний чинник (∆H) і ентропійний чинник (T∆S) не дорівнюють нулю.
Коли ∆H<<0 і T∆S>>0, здатність речовин до хімічної взаємодії максимальна. При ∆H>0 і T∆S<0, самовільно процес не відбува-ється.
В таблиці __ показана можливість (або неможливість) само-вільного перебігу реакції при різних комбінаціях знаків  і
і  .
.
Якщо для будь-якої реакції ∆H<0 (екзотермічна реакція), а ∆S>0, то з рівняння ∆G = ∆H-T . ∆S випливає, що ∆G<0. Це значить, що самовільний перебіг реакції можливий при будь-яких температурах.
|
|
|
Якщо ∆H<0 і ∆S<0, то реакція можлива за умови, що член ∆H більший за модулем, ніж член T∆S.
Оскільки абсолютне значення ентропійного чинника з ростом температури збільшується, то умова перебігу реакції буде виконуватись при досить низьких температурах. Отже, при низьких температурах найбільш імовірним є самовільний перебіг екзот-термічних реакцій, навіть якщо ентропія системи зменшується.
Як видно з таблиці 7, при високих температурах найбільш можливим є перебіг реакцій, які супроводжуються зростанням ентропії, в тому числі і ендотермічних.
Таблиця 7
Напрямок перебігу реакцій при різних знаках ∆H і ∆S
| Знак зміни функції | Можливість (неможливість) самовільного перебігу реакції | Приклад реакції | ||
| ∆H | ∆S | ∆G | ||
| - | + | - | Можливий при будь-яких температурах | 
|
продовження табл.7
| + | - | + | Неможливий при будь-яких температурах | 
|
| - | - | 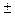
| Можливий при досить низьких температурах | 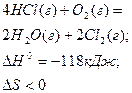
|
| + | + | 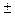
| Можливий при досить високих температурах | 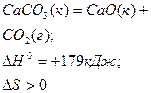
|
Слід додати, що від’ємне значення ∆G тієї або іншої реакції вказує тільки на можливість її перебігу. Реакція може при цьому не спостерігатись через те, що швидкість її може бути дуже мала. Тоді, незважаючи на додержання умови ∆G<0, реакція практично не відбувається. У цих випадках для збільшення швидкості реакції слід підібрати каталізатор. Особливо часто це спостерігається при низьких температурах.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1689; Нарушение авторских прав?; Мы поможем в написании вашей работы!