
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реагуючих речовин
Залежність швидкості реакції від концентрації
Необхідною умовою хімічної взаємодії речовин є зіткнення частинок (молекул, йонів). Тому швидкість пропорційна кількості співударів частинок реагуючих речовин.
В 1867 році норвезькі вчені К. Гульдберг і П. Вааге відкрили закон дії мас: при сталій температурі швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин, піднесених до степенів, які дорівнюють їх стехіометричним коефіцієнтам.
Наприклад, 2А + В = А2В - гомогенна реакція.
Тоді v = k[А]2. [В], де [А], [В] - молярні концентрації реагуючих речовин, k - константа швидкості реакції, яка залежить від природи реагуючих речовин, від температури і від присутності аталізаторів, але не залежить від концентрацій речовин.
У випадку гетерогенних реакцій в рівняння закону дії мас входять концентрації тільки тих речовин, які знаходяться в газовій фазі або в розчині. Концентрація речовини в твердій фазі - стала величина і тому входить в константу швидкості. Наприклад, для реакції горіння вугілля

закон дії мас запишеться так:
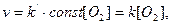
де k = k’ . const.
В дійсності реакції відбуваються значно складніше. Одночасне зіткнення трьох молекул малоімовірне. Отже при перебігу складних реакцій відбуваються послідовні або паралельні процеси, кожний з яких здійснюється при зіткненні двох частинок. В цих випадках закон діючих мас може бути застосований тільки до кожної окремої стадії реакції і не може бути застосований до всієї реакції в цілому.
|
|
Дата добавления: 2015-05-24; Просмотров: 471; Нарушение авторских прав?; Мы поможем в написании вашей работы!