
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Властивості розчинів неелектролітів
|
|
|
|
Як вже відомо, в розчинах частинки рівномірно розподілені по усьому об'єму. Наприклад, якщо на концентрований розчин цукру обережно налити шар чистої води, то молекули цукру, перебуваючи в хаотичному тепловому русі, поступово рівномірно розподіляються в усьому об'ємі рідини. Одночасно і молекули води, потрапляючи в розчин цукру, розбавляють його. Обидва ці процеси відбуваються самовільно до того часу, поки не відбудеться повне вирівнювання концентрації цукру в усьому об'ємі розчину.
Самовільний процес переносу речовини, в результаті якого встановлюється рівноважне розподілення концентрацій внаслідок невпорядкованого теплового руху молекул, атомів, йонів в газах, рідинах або в твердих тілах, називається дифузією. Дифузія відбувається і при змішуванні розчинів різних концентрацій, а також в твердих тілах і газах.
Як правило, дифузія частинок відбувається з області більшої їх концентрації в область меншої концентрації. Швидкість дифузії зростає при підвищенні температури і збільшенні градієнта концентрації, тобто зміни концентрації, яка припадає на одиницю відстані, і зменшується при збільшенні в'язкості середовища і радіуса частинок.
Явище дифузії відіграє дуже важливу роль в життєдіяльності організмів, в процесах переміщення поживних речовин і продуктів обміну в тканинних рідинах.
Дифузія може відбуватись також, якщо на межі розчину і чистого розчинника (або двох розчинів різної концентрації) розмістити напівпроникну перетинку-мембрану. Напівпроникні перетинки пропускають тільки молекули розчинника і не пропускають молекули розчиненої речовини. Властивість напівпроникності мають природні плівки (стінки клітин живих і рослинних організмів, стінки кишечника), а також плівки штучного походження (пергамент, целофан, плівки з желатини).
|
|
|
Одностороння самовільна дифузія молекул розчинника через напівпроникну мембрану в розчин або з розчину з низькою концентрацією в розчин з високою концентрацією називається осмосом. Осмос можна спостерігати в спеціальних приладах – осмометрах (рис. 23).
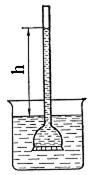
|
| Рис. 23. Схематичне зображення осмометра (h -висота підйому розчину в трубці осмометра) |
Основна його деталь - осмотична комірка, відділена від посудини з чистим розчинником напівпроникною мембраною, яка пропускає тільки молекули розчинника. Комірку з концентрованим розчином занурюють в посудину з розчинником або менш концентрованим розчином. Через деякий час відмічається значне підвищення рівня рідини в трубці. Пояснюється це тим, що з поверхнею мембрани знизу стикається більше молекул розчинника, ніж зверху, тому що зверху частина поверхні зайнята молекулами розчиненої речовини, яка не проходить через мембрану. Тому в одиницю часу догори переходить значно більше молекул розчинника, ніж в зворотному напрямку.
Рівень рідини в осмотичній трубці буде підвищуватись, доки гідростатичний тиск стовпчика рідини висотою h не затримає осмос. В цьому випадку зрівноважуються швидкості руху розчинника з зовнішньої посудини в комірку і з комірки в зовнішній розчин. Гідростатичний тиск, який треба прикласти до розчину, щоб затримати осмос, називають осмотичним тиском. Він є кількісною характеристикою осмосу.
Вимірявши осмотичний тиск різних розчинів, встановили, що величина осмотичного тиску залежить від концентрації розчину і його температури, але не залежить від природи розчиненої речовини і розчинника. В 1886р. Вант-Гофф - видатний голландський фізико-хімік показав, що для розчинів неелектролітів невисоких концентрацій залежність осмотичного тиску від концентрації і температури розчину виражається рівнянням:
|
|
|
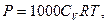
де Р - осмотичний тиск розчину, Па; СМ - молярна концентрація (молярність), моль/л; R - універсальна газова стала, 8,314 Дж/(мольК); Т - абсолютна температура розчину.
Як вже відомо, молярність розчину СМ - це відношення кількості розчиненої речовини n до об'єму розчину V (л):
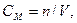
а кількість речовини дорівнює її масі m, поділеній на молярну масу М, звідси для молярності розчинів маємо:
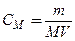 .
.
Підставивши це значення СМ в рівняння Вант-Гоффа, одер-жимо:
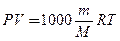 .
.
Осмос має велике значення в процесах життєдіяльності тварин і рослин. Він зумовлює підняття води по стеблу рослини, ріст клітин і багато інших явищ. Осмотичний тиск в клітинах зумовлює їх пружність і еластичність, а також сприяє зберіганню певної форми стебла і листя рослин. Кожна жива клітина має або оболонку, або поверхневий шар протоплазми, які мають властивість напівпроникності. Якщо клітину вмістити в розчин, концентрація якого дорівнює концентрації клітинного соку, то стан клітини не зміниться, тому що осмотичний тиск в клітині і в розчині однакові.
Розчини, які мають за однакових умов однаковий осмотичний тиск, одержали назву ізотонічних.
В концентрованих сольових розчинах клітина зморщується (плазмоліз), що зумовлено втратою води в більш концентрований зовнішній розчин, тому що осмотичний тиск зовнішнього розчину вищій, ніж в клітині. Такий розчин має назву гіпертонічний.
В розчині, концентрація якого нижча за концентрацію клітинного соку, клітина всмоктує воду, що пояснюється більш низьким, ніж в клітині, осмотичним тиском розчину. Такі розчини одержали назву гіпотонічних.
Кров, лімфа, а також будь-які тканинні рідини людини і тварин - це водні розчини молекул і йонів багатьох речовин - органічних і мінеральних. Ці розчини мають певний осмотичний тиск, наприклад, осмотичний тиск крові дорівнює 800000 Н/м2. Такий самий тиск має 0,9%-ний розчин натрій хлориду, який є по відно-шенню до крові ізотонічним. Саме тому такий розчин застосовують в хірургії під назвою фізіологічний як кровозамінювач.
На застосуванні осмотичного тиску засноване консервування овочів і фруктів. Високі концентрації цукру або солі в консерванті спричиняють високий осмотичний тиск, внаслідок чого мікроорганізми гинуть в результаті плазмолізу.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1538; Нарушение авторских прав?; Мы поможем в написании вашей работы!