
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні положення теорії електролітичної дисоціації
|
|
|
|
Тема 7. Розчини електролітів
Задачі для самостійного розв’язування
1. Визначити масу безводного ферум(ІІ) сульфату, який міститься в розчині (р = 1,10 г/мл) об’ємом 800 мл, де його масова частка дорівнює 10%.
2. До розчину об’ємом 100 мл з масовою часткою Н2SО4 48% добавили 900 мл води. Визначити ω(H2SO4) для одержаного розчи-ну.
3. В 2 л розчину міститься 21,22 Na2CO3. Визначити молярну концентрацію та молярну концентрацію еквівалента цього розчину.
4. Визначити моляльну концентрацію розчину, приготованого з глюкози масою 9 г і води об’ємом 500 мл.
5. Для нейтралізації розчину лугу об’ємом 40 мл використано 24 мл розчину сульфатної кислоти, малярна концентрація еквіва-лента якого дорівнює 0,5 моль/л. Обчислити молярну концентрацію лугу.
6. Визначити молярну концентрацію розчину неелектроліта, якщо при 170 С його осмотичний тиск дорівнює 1204,5 Па.
7. В 2 л розчину при 270 С міститься 8 г неелктроліта і його осмотичний тиск дорівнює 52,676 кПа. Визначити молекулярну масу Mr розчиненої речовини.
8. Визначити молекулярну масу Mr розчиненої речовини, якщо 3,52 г цієї речовини утворює з 25,2 г води розчин, тиск насиченої пари якого при 700 С дорівнює 30,728 кПа. Тиск насиченої пари води при тій самій температурі дорівнює 31,157 кПа.
9. При якій температурі має кипіти і замерзати водний розчин, в якому масова частка сахарози С12Н22О11 дорівнює 50%?
10. На скільки градусів підвищиться температура кипіння і понизиться температура замерзання, якщо у воді об’ємом 1 л розчинити глюкозу С6Н12О6 масою 90 г?
Результати багатьох експериментів показали, що розчини кислот, лугів і солей не підлягають законам Вант-Гоффа і Рауля. Для них осмотичний тиск, зниження температур замерзання і підвищення температур кипіння завжди більші, ніж розраховані за концентрацією розчинів. Щоб застосувати рівняння Р = 1000 CМRT до розчинів з „ненормальним” осмотичним тиском Вант-Гофф ввів у нього поправочний коефіцієнт і, який одержав назву – ізотонічний:
|
|
|
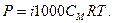
Коефіцієнт і обчислили, визначивши експериментально осмо-тичний тиск, зниження температур замерзання, підвищення температур кипіння розчинів і поділивши ці величини на теоретично обчислені за аналітичними концентраціями. Тоді
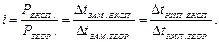
Окрім того, було відомо, що водні розчини кислот основ і солей проводять електричний струм.
Речовини, які проводять електричний струм в розчиненому або розплавленому стані, одержали назву - електроліти. Поняття про електроліти вперше ввів англійський фізик Фарадей в 30-х роках ХІХ сторіччя.
Явище електропровідності електролітів вивчав шведський вчений С.Арреніус (1887 р.), який прийшов до висновку, що при розчиненні в воді солей, основ і кислот молекули їх розпадаються (дисоціюють) на окремі частинки-йони, заряджені протилежними за знаком електричними зарядами. Під дією електричного струму позитивно заряджені йони рухаються до катода, негативно заряджені – до анода, тому і одержали назву катіони і аніони.
Арреніус звернув увагу на зв’язок між електропровідністю кислот, основ і солей і відхиленням їх розчинів від законів Вант-Гоффа і Рауля. Обидві властивості цих розчинів пов’язані із збільшенням числа частинок. З одного боку, в результаті дисоціації електролітів на йони збільшується загальне число частинок в розчині, що призводить до збільшення осмотичного тиску, зміни температур кипіння і замерзання, з другого боку, йони – заряджені частинки, тому надають розчинам здатність проводити електричний струм.
За теорією Арреніуса йони вважались вільними частинками, незалежними від розчинника. В 1891 р. російський вчений І.Каблуков ввів уявлення про гідратацію (в загальному випадку – сольватацію) утворених при дисоціації йонів і тим самим пов’язав теорію електролітичної дисоціації з гідратною теорією розчинів Д.Менделєєва.
|
|
|
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 874; Нарушение авторских прав?; Мы поможем в написании вашей работы!