
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Складання рівнянь окисно-відновних реакцій
|
|
|
|
В окисно-відновних реакціях можуть брати участь тільки окисник і відновник, але частіше реакції такого типу мають складніший характер: в них бере участь ще середовище. В залежності від середовища продукти реакції можуть бути різні. Наприклад,  в кислому середовищі відновлюється до Mn+2, в нейтральному – до
в кислому середовищі відновлюється до Mn+2, в нейтральному – до  , а в лужному – до
, а в лужному – до 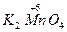 .
.
Розглянемо порядок складання рівнянь окисно-відновних реакцій за методом електронного балансу на прикладі взаємодії нітритної кислоти з калій перманганатом в кислому середовищі.
При складанні рівнянь окисно-відновних реакцій рекомендується дотримуватись такого порядку.
1. Скласти схему реакції, вказавши вихідні речовини і продукти реакції:
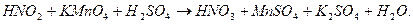
2. Визначити і записати ступені окиснення атомів, які змінили їх в ході реакції; знайти окисник і відновник:
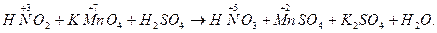 відновник окисник
відновник окисник
2. Записати електронні рівняння окиснення-відновлення для кожного з елементів, які змінили ступені окиснення:
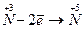 - окиснення;
- окиснення;
 - відновлення.
- відновлення.
3. Визначити найменше спільне кратне для чисел електронів, відданих однією частинкою відновника і прийнятих однією частинкою окисника. Найменше спільне кратне записують зліва, а множники, на які необхідно помножити електронні рівняння для досягнення електронного балансу, записують справа від рівнянь:
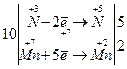
Знайдені множники і є коефіцієнтами в рівнянні реакції перед сполуками, що містять відповідні елементи. У випадках, коли в одній молекулі міститься більше одного атома елементу, що бере участь в обміні електронів, множник необхідно поділити на число атомів цього елемента в молекулярній формулі його сполуки:
 4. Зрівняти число атомів інших елементів в правій і лівій частинах рівняння (окрім Н і О).
4. Зрівняти число атомів інших елементів в правій і лівій частинах рівняння (окрім Н і О).
|
|
|
В правій частині рівняння є три залишки сульфатної кислоти, отже, в реакції бере участь три молекули сульфатної кислоти:
 5. Зрівняти число атомів Гідрогену і Оксигену. Тоді молекулярне рівняння буде мати вигляд:
5. Зрівняти число атомів Гідрогену і Оксигену. Тоді молекулярне рівняння буде мати вигляд:
 Для підбору коефіцієнтів в рівняннях окисно-відновних реакцій, що відбуваються в розчинах електролітів, користуються електронно-йонним методом. Сутність його полягає в тому, що складаються допоміжні електронно-йонні рівняння, в яких показується перехід електронів від одних йонів і атомів до інших і враховується характер середовища (лужне, кисле, нейтральне), в якому відбувається реакція. Для зрівнювання числа атомів Оксигену і Гідрогену, що входять до складу йонів і молекул, які окиснюються або відновлюються, слід вводити в електронно-йонні рівняння молекули води і йони Гідрогену, якщо реакція відбувається в кислому середовищі, і молекули води і гідроксид-йони, якщо реакція відбувається в лужному середовищі.
Для підбору коефіцієнтів в рівняннях окисно-відновних реакцій, що відбуваються в розчинах електролітів, користуються електронно-йонним методом. Сутність його полягає в тому, що складаються допоміжні електронно-йонні рівняння, в яких показується перехід електронів від одних йонів і атомів до інших і враховується характер середовища (лужне, кисле, нейтральне), в якому відбувається реакція. Для зрівнювання числа атомів Оксигену і Гідрогену, що входять до складу йонів і молекул, які окиснюються або відновлюються, слід вводити в електронно-йонні рівняння молекули води і йони Гідрогену, якщо реакція відбувається в кислому середовищі, і молекули води і гідроксид-йони, якщо реакція відбувається в лужному середовищі.
Слід пам’ятати, що на один атом Оксигену, що вивільнюється з частинки (молекули, йону) окисника в кислому середовищі витрачається два йони Н+ і утворюється одна молекула води, а в нейтральному і лужному середовищі витрачається одна молекула води і утворюється 2 йони ОН-; на один атом Оксигену, що приєднується до частинки відновника, витрачається в кислому і нейтральному середовищі одна молекула води і утворюється два йони Н+, а в лужному середовищі – два йони ОН- і утворюється одна молекула води.
Розглянемо це на прикладі окиснення калій сульфіту калій перманганатом в кислому, нейтральному і лужному середовищі.
1. Реакція відбувається в кислому середовищі:
1.1. Складаємо схему реакції в молекулярній, а потім в йонній формі:
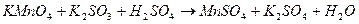 ;
;
 .
.
1.2. Визначаємо окисник і відновник, а також продукти окиснення і відновлення.
В наведеній реакції окисник MnO4- відновлюється до Mn2+, а відновник SO32- окиснюється в SO42 -.
|
|
|
1.3. Cкладаємо електронно-йонні рівняння для окисника і відновника з врахуванням Оксигену і Гідрогену.
Для зв’язування чотирьох атомів Оксигену, що входять до складу йона окисника MnO4 -, необхідно ввести вісім йонів Н+, з яких утворюється чотири молекули води:
 . (1)
. (1)
На один атом Оксигену, що приєднується до частинки відновника, витрачається в кислому середовищі одна молекула води і утворюється два йони Н+:
 (2)
(2)
1.4. Зрівнюємо число зарядів продуктів реакції і число зарядів вихідних речовин в йонних рівняннях для окисника (1) і відновника (2), для чого до першого додаємо  , а від другого віднімаємо
, а від другого віднімаємо  :
:
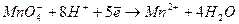 (3)
(3)
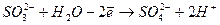 (4)
(4)
Враховуючи, що число електронів, прийнятих окисником, має дорівнювати числу електронів, відданих відновником, необхідно рівняння (3) помножити на 2, а рівняння (4) – на 5.
Отримаємо:

 (5)
(5)
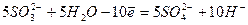 (6)
(6)
1.6. Для одержання сумарного йонного рівняння окисно-відновної реакції рівняння (5) і (6) складаємо:

2.7. З сукупності всіх йонів складаємо молекулярне рівняння:
 .
.
3. Реакція відбувається в нейтральному середовищі:
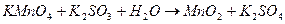 - молекулярна форма;
- молекулярна форма;
 - йонна форма.
- йонна форма.
електронно-йонні рівняння:
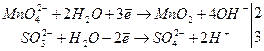
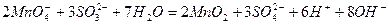
сумарне йонне рівняння;

молекулярне рівняння.
4. Реакція відбувається в лужному середовищі:
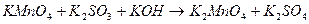 - молекулярна
- молекулярна
форма;
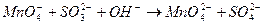 - йонна форма.
- йонна форма.
молекулярно-йонні рівняння:


сумарне йонне рівняння;

молекулярне рівняння.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 712; Нарушение авторских прав?; Мы поможем в написании вашей работы!