
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електродні потенціали
Тема 10. Електрохімічні процеси
Електрохiмiя - це галузь хiмiї, яка охоплює хiмiчнi процеси, що супроводжуються виникненням електричного струму або якi спричиненi дiєю електричного струму.
Розглянемо процеси, якi вiдбуваються при зануреннi металу - провiдника першого роду - в розчин електролiта. Такий провiдник 1-го роду, занурений в розчин електролiта в умовах проходження через нього струму, називають електродом. На межi електрод - розчин електролiта виникає стрибок електричного потенцiалу, який називають електродним потенцiалом. Це пояснюється таким чином.
В металi встановлюється рухлива рiвновага:
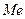 L
L  (1)
(1)
Перехiд йонiв металу в розчин виражається рiвнянням:
 L
L 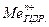 (2)
(2)
Можна об'єднати рiвняння (1) i (2):
 L
L  (3)
(3)
Цей процес супроводжується втратою електронiв, тобто - це окиснення. Зворотний процес – відновлення (рис.30).
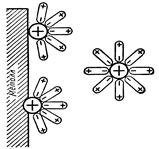
Рис. 30. Схема взаємодії йонів поверхневого шару металу з молекулами води
Стан рiвноваги (3) залежить вiд активностi металу i вiд концентрацiї його йонiв в розчинi. Якщо ця концентрацiя менша за рiвноважну, то при зануреннi металу в розчин рiвновага зсувається вправо - йони металу переходять в розчин, а електрони залишаються на поверхнi металу. Саме тому метал набуває вiд'ємного заряду вiдносно розчину. Чим бiльше йонiв переходить в розчин, тим бiльшим стає вiд'ємний заряд металу. Накопичення йонiв металу в розчинi починає гальмувати розчинення металу. Внаслiдок цього встановлюється рухлива рiвновага.
Внесення в розчин однойменних йонiв зсуває рiвновагу (3) влiво, доки не встановиться новий стан рiвноваги. Гiдратованi йони металу концентруються бiля поверхнi електрода. В результатi цього утворюється подвiйний електричний шар.
Для неактивних металів рівноважна концентрація йонів дуже мала. Якщо занурити неактивний метал в розчин солi з концентрацiєю однойменних йонiв бiльше тої, що вiдповiдає рiвновазi, то частина катiонiв з розчину перейде на електрод.
Поверхня електрода набуває додатнього заряду, а розчин - вiд'ємного (рис.31).

а) б)
Рис. 31. Подвійний електричний шар на межі поділу метал-розчин:
а – активний метал; б – малоактивний метал
Електродний потенціал металу залежить від властивостей металу, концентрації, або точніше, від активності його йонів і температури.
Ця залежність виражається формулою Нернста:
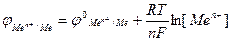 (4)
(4)
де [Men+] - концентрація йонів металу, моль/л;  - елек-тродний потенцiал при [Men+] = 1моль/л; R - унiверсальна газова стала, яка дорiвнює 8,314 Дж/(мольК); Т - температура, К; n – число електронів, що беруть участь в процесі; F – стала Фарадея - 96494 Кл/моль.
- елек-тродний потенцiал при [Men+] = 1моль/л; R - унiверсальна газова стала, яка дорiвнює 8,314 Дж/(мольК); Т - температура, К; n – число електронів, що беруть участь в процесі; F – стала Фарадея - 96494 Кл/моль.
Пiдставимо в формулу (4) числовi значення R i F i замiнимо натуральний логарифм десятковим, помноживши на 2,3, тодi одержимо для температури 250 С:
 (5)
(5)
Електродний потенціал є сталою величиною при певній температурі, якщо платівка металу занурена в розчин його солі з концентрацією (або активністю) йонів металу, що дорівнює одиниці ([Men+]=1 або аі =1).Такий потенціал називають стандартнимелектродним потенціалом. Якщо [Men+]=1, з рівняння (5) одержимо: 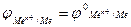 .
.
|
|
Дата добавления: 2015-05-24; Просмотров: 412; Нарушение авторских прав?; Мы поможем в написании вашей работы!