
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічні джерела електричної енергії
|
|
|
|
В окисно-відновних реакціях електрони безпосередньо переходять від відновника до окисника. Однак, якщо процеси окиснення і відновлення просторово розділити, а електрони направити по металічному провіднику, то така система буде являти собою гальванічний елемент.
Отже, гальванiчними елементами називають пристрої, в яких хiмiчна енергiя окисно-вiдновної реакцiї перетворюється в електричну.
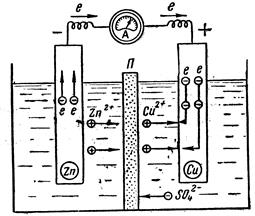
Рис. 32. Схема роботи мідно-цинкового гальванічного елементу
Гальванiчний елемент складається з двох електродiв, занурених в розчини (або розплави) електролiтiв. На межi кожного електрода з розчином електролiта iснує електродний потенцiал. Потенцiали електродiв неоднаковi, саме тому при з’єднаннi їх провiдником по ньому протiкає електричний струм. Розглянемо мiдно-цинковий гальванiчний елемент, або елемент Даніеля-Якобі (рис.32).
Платівки з міді і цинку з’єднані провідником і занурені в розчини відповідних солей: купрум(ІІ) сульфату і цинк сульфату. Півелементи знаходяться в одній посудині або розділені пористою перетинкою.
На цинковому електроді, зануреному в розчин солі ZnSO4, відбувається окиснення атомів цинку:

Електрони по зовнішньому колу рухаються від цинку до міді.
На мідному електроді, зануреному в розчин CuSO4, відбувається відновлення йонів Cu2+ в атоми, які осаджуються на електроді:
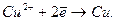
Одночасно частина йонів SO42- переходить з посудини з CuSO4 через пористу перетинку в посудину з розчином ZnSO4. В результаті рідина біля обох електродів залишається електро-нейтральною.
Сумарне рівняння процесу одержимо, додавши обидва рівняння:
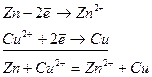
або в молекулярній формі:

Електрод, на якому відбувається процес окиснення, називається анодом, а електрод, на якому відбувається процес відновлення – катодом.
|
|
|
Анод – від’ємний електрод. Катод – додатній.
Гальванічні елементи можна зображати схемами, наприклад, елемент Даніеля-Якобі можна зобразити так:
 ,
,
де одна вертикальна лінія означає межу між електродом і розчином, дві вертикальні лінії – межу між розчинами, в дужках – знаки полюсів.
Якщо концентрації йонів металів в розчинах солей стандартні, тобто дорівнюють 1 моль/л, то електрорушійна сила гальванічного елемента обчислюється за формулою:
 ,
,
де Е – е.р.с. гальванічного елемента;  і
і  - стандартні електродні потенціали металів - окисника і відновника.
- стандартні електродні потенціали металів - окисника і відновника.
Якщо умови нестандартні, то спочатку за формулою Нернста обчислюють електродні потенціали металів за заданими концентраціями солей, а потім знаходять їх різницю, віднімаючи від потенціалу окисника потенціал відновника.
Обчислимо е.р.с. мідно-цинкового гальванічного елемента за стандартних умов. Знаходимо в таблиці ___ стандартні електродні потенціали цинку і міді:
 ,
,  .
.
Тоді  .
.
Якщо в тому ж мідно-цинковому гальванічному елементі [Cu2+] =0,01 моль/л, а [Zn2+] =0,1 моль/л, то потенціали мідного і цинкового електродів, обчислені за формулою Нернста, відповідно дорівнюють:
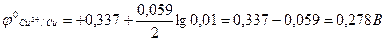 .
.
 .
.
Звідки 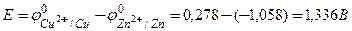 .
.
Гальванічний елемент може бути складений не тільки з різних, але й з однакових електродів, занурених в розчини одного і того ж електроліту, які розрізняються тільки концентрацією (концентраційні гальванічні елементи). Е.р.с. такого елемента також дорівнює різниці потенціалів його електродів, причому від більшого за алгебраїчною величиною віднімають менший.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 614; Нарушение авторских прав?; Мы поможем в написании вашей работы!