
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Спільні стадії внутрішньоклітинного катаболзму біомолекул: білків, вуглеводів, ліпідів. 2 страница
|
|
|
|
Корозійне руйнування може поширюватися на всю поверхню металу – суцільна (загальна) корозія та на окремі ділянки – місцева (локальна) корозія.
Залежно від механізму процесу розрізняють хімічну (газову) та електрохімічну корозію (корозія в розчинах електролітів).
2. Хімічна корозія розвивається при контакті металу з розчинами неелектролітів або з газами при високих температурах. Відбувається безпосереднє окиснення металу окислювачами – компонентами навколишнього середовища. На поверхні металів утворюються відповідні сполуки: оксиди, сульфіди.
Найнебезпечнішими для металів компонентами газового середовища є кисень, водяна пара, вуглекислий газ, діоксид сульфуру.
Газової корозії зазнає арматура печей, деталі ДВЗ, лопатки газових турбін;
Способи захисту: жаростійкі сплави для виготовлення апаратури (до сталі і чавуну вводять хром, кремній, алюміній, сплави на основі нікелю або кобальту), насичення у гарячому стані поверхні виробу деякими металами, що мають захисну дію (алітування, термохромування).
3. Електрохімічна корозія розвивається при контакті металу з розчинами електролітів.
До електрохімічної корозії належать:
· Морська корозія
· Корозія у розчинах,
· Атмосферна корозія
· Ґрунтова корозія
· Корозія при нерівномірній аерації
· Контактна корозія
Електрохімічна корозія відбувається за електрохімічним механізмом. На металі відбуваються одночасно 2 процеси – окиснення металу (анодний процес) і відновлення окисників – компонентів середовища (катодний процес).
Як правило, окислювачами у водних розчинах у кислому середовищі є йони гідрогену Н+ або розчинений у воді кисень повітря. Так корозія у кислому середовищі супроводжується таким катодним процесом: 2Н+ + 2е → Н2
|
|
|
Катодний процес під час корозії з участю кисню відбувається за рівнянням
О2 + 2Н2О + 4е → 4ОН-
Приклад: корозія заліза
А) в розчині кислоти
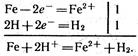
Б) в лужному або нейтральному середовищі
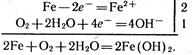
Продукт корозії заліза – бура іржа є складною сумішшю гідроксидів феруму ІІ і ІІІ, продуктів їх розкладання і взаємодії з СО2 та іншими речовинами навколишнього середовища.
Метали, що мають позитивний стандартний електродний потенціал, піддаються корозії тільки за участю кисню в усіх середовищах. Пр: корозія міді

Атмосферна корозія – корозія у вологому повітрі при звичайних температурах. Поверхня металу, що міститься у вологому повітрі, буває вкрита плівкою води, яка містить різні гази. Швидкість атмосферної корозії залежить від вологості повітря і вмісту газів у ньому, які утворюють з водою кислоти, стан поверхні металу.
Ґрунтова корозія – відбувається при контакті металів з ґрунтовими водами, що містять розчинене повітря. Швидкість корозії залежить від складу ґрунтових вод, структури і мінералогічного складу грунту. Пр.: руйнування трубопроводів, оболонок кабелів, деталей будівельних споруд.
Морська корозія – відбувається при контакті металів з морською водою. Пр.: обшивка кораблів, устаткування, що застосовується в портах
Контактна корозія – відбувається, коли два метали з різними потенціалами контактують один з одним або у водному середовищі, або при наявності вологи, що конденсується з повітря. Метали один одного поляризують і метал з меншим потенціалом поляризується анодно і швидкість його корозії поблизу місця контакту різко зростає.
Пр.: у теплофікаційних установках, коли мідні нагрівні змійовики з’єднані з залізними кип’ятильниками або трубами. Інтенсивна корозія заліза спостерігається біля місць з’єднань.
Корозія при нерівномірній аерації спостерігається у тих випадках, коли деталь або конструкція міститься у розчині, але доступ розчиненого ксиню до різних її частин неоднаковий. При цьому ті частини металу, до яких доступ кисню мінімальний, кородують значно більше, ніж ті частини, доступ до яких більший. Такий нерівномірний розподіл корозії можна прояснити так. При відновленні кисню О2 + 4Н+ + 4е → 2Н2О витрачаються йони гідрогену, і тому розчин трохи підлуговується. Метали при підлуговуванні розчину легше переходять у пасивний стан. Тому керовані ділянки металу переходять у пасивний стан і швидкість корозії на них знижується. На некерованих ділянках не відбувається пасивування – тут відбувається процес окиснення металу, що приводить до переходу його йонів у розчин: Ме → Mez+ + ze
|
|
|
4. Захист від електрохімічної корозії:
1) застосування хімічно стійких сплавів (нержавіючі і кислототривкі сталі, до складу яких входить до 18% хрому і до 10% нікелю); легування
2) захист поверхні металів покриттями
А) металічними
Застосовують метали, які утворюють на своїй поверхні захисні плівки (хром, нікель, цинк, кадмій, алюміній, олово). Значно рідше застосовують метали, що мають високий електродний потенціал – срібло, золото.
Б) неметалічні
Покриття лаками, фарбами, емалями, фенолформальдегідними смолами, полімерами.
В) покриття, утворені внаслідок хімічної або електрохімічної обробки поверхні металу
Захисні оксидні і сольові плівки. Пр.: оксидування алюмінію, фосфатування стальних виробів (плівки з фосфатів).
3) використання інгібіторів корозії
Інгібітори вводять в робоче середовище або наносять на метал. Інгібітори адсорбуються на поверхні металу і тим самим запобігають перебігу корозійних процесів. Деякі інгібітори сприяють видаленню кисню з робочого середовища.
Пр.: нітрит натрію, хромат і дихромат калію, фосфати натрію
4) електрохімічні методи
А) катодний захист
Конструкцію приєднують до негативного полюса джерела електричної енергії і вона стає катодом. Як анод використовують шматки заліза. При відповідній силі струму в колі на виробі, який захищають, відбувається відновлення окисника, окислюється речовина аноду. Використовується для захисту стального устаткування від корозії в морській воді та ґрунті.
|
|
|
 Схема катодного захисту металу:
Схема катодного захисту металу:
1 – металевий виріб, який захищають;
2 – джерело струму;
3 – допоміжний метал
Б) протекторний захист
Полягає в приєднанні до металу великого листа, виготовленого з іншого, активнішого металу – протектора. Як протектор при захисті стальних виробів звичайно застосовують цинк або сплави на основі магнію. На залізі відбувається процес відновлення того окисника, який є у воді, а цинк окислюється.
Контрольні запитання:
- Що називається корозією металів?
- Які види корозії ви знаєте?
- Які процеси відбуваються при корозії цинку в кислому та лужному середовищах.
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. – Гл. ХVІ, § 196, с. 554-560.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІ, Гл. 12, §§ 99-100, с. 112-114.
РОЗДІЛ 5. МЕТАЛИ ТА МАТЕРІАЛИ
Тема 5.1. Метали та їх сплави
1. Загальні властивості металів.
- Кристалічна будова металів.*
- Сплави. *
1. Метали мають ряд загальних властивостей. Причиною однакових фізичних і хімічних властивостей металів є подібність будови їхніх атомів і природи кристалічних решіток металів. До загальних фізичних властивостей металів належать: висока електропровідність, висока теплопровідність, пластичність, металічний блиск, непрозорість.
Пластичність – здатність деформуватися при звичайній і підвищеній температурі, не руйнуючись. Пластичність металів пояснюється специфічними властивостями металічного зв’язку. При механічному впливі на тверде тіло окремі шари його кристалічної решітки зміщуються відносно один одного. У кристалах з атомною структурою це призводить до розривання ковалентних зв’язків між атомами, що належать різним шарам, і кристал руйнується. У кристалах з йонною структурою при взаємному зміщенні шарів неминуче створюється таке положення, при якому поряд виявляються однойменно заряджені йони. При цьому виникають сили електростатичного відштовхування і кристал також руйнується. При зміщенні окремих шарів кристалічної решітки металу відбувається лише деякий перерозподіл електронного газу, що зв’язує атоми металу один з одним, але хімічні зв’язки не розриваються – метал деформується, не руйнуючись. Завдяки цій властивості метали можна кувати, прокатувати, витягувати в дріт, штампувати.
|
|
|
Металічний блиск зумовлюється здатністю металів добре відбивати світло.
Висока тепло- і електропровідність металів зумовлені можливістю вільного переміщення електронів зони провідності.
З погляду хімії всі метали порівняно легко віддають валентні електрони і, як наслідок цього, здатні утворювати позитивно заряджені йони і виявляти у своїх сполуках тільки позитивну окислюваність. Металів у різних сполуках завжди мають позитивний ступінь окиснення. У зв’язку з цим метали у вільному стані є відновниками. Відновна здатність різних металів неоднакова. Для реакцій у водних розчинах вона визначається положенням металу в ряду напруг і концентрацією його йонів у розчині.
2. Кристалічну будову металів вивчають різними методами. Їх можна розділити на дві групи. До першої належать методи вивчення внутрішньої будови кристалів. До другої – методи вивчення їхніх зовнішніх форм.
Внутрішню будову кристалів вивчають, головним чином, за допомогою рентгеноструктурного аналізу. За його даними для всіх металів установлено типи і параметри кристалічних граток.
Кристалічні гратки металів можуть бути різних типів. Однак для більшості металів характерні три типи граток:
· об’ємноцентрована кубічна (Li, Na, K, V, Cr, Fe(при температурах до 912ºС і від 1394ºС до плавлення), Pb, W)
· гранецентрована кубічна (Al, Fe(від 912ºС до 1394ºС), Ca, Ni, Cu, Ag, Au)
· гексагональна (Be, Mg, Cd, Ti, Co, Zn)
 а) об’ємноцентрована кубічна
а) об’ємноцентрована кубічна
б) гранецентрована кубічна
в) гексагональна
Розміри, форму і взаємне розміщення кристалів у металах вивчають металографічними методами. Найповнішу оцінку структури металу з цього погляду дає мікроскопічний аналіз його шліфу. З досліджуваного металу вирізають зразок і його площину шліфують, полірують і протравлюють спеціальним розчином (травником). В результаті травлення виявляється структура зразка, яку розглядають або фотографують за допомогою металографічного мікроскопа.
 Кристали металів звичайно мають невеликі розміри. Тому будь-який металевий виріб складається з великої кількості кристалів. Така структура називається полікристалічною. При кристалізації металу з розплавленого стану кристали, що ростуть, заважають один одному набувати правильної форми. Тому кристали полікристалічного тіла мають неправильну форму і на відміну від правильно огранованих кристалів називаються кристалітами, або зернами. Зерна розрізняються між собою просторовою орієнтацією їхніх кристалічних решіток.
Кристали металів звичайно мають невеликі розміри. Тому будь-який металевий виріб складається з великої кількості кристалів. Така структура називається полікристалічною. При кристалізації металу з розплавленого стану кристали, що ростуть, заважають один одному набувати правильної форми. Тому кристали полікристалічного тіла мають неправильну форму і на відміну від правильно огранованих кристалів називаються кристалітами, або зернами. Зерна розрізняються між собою просторовою орієнтацією їхніх кристалічних решіток.
Схема різної орієнтації кристалічних решіток у полікристалічному тілі
 При травленні шліфу межі зерен роз’їдаються більше; вони стають поглибленими. Світло, падаючи на них, розсіюється, і в полі зору мікроскопа межі зерен здаються темними, а самі зерна – світлими.
При травленні шліфу межі зерен роз’їдаються більше; вони стають поглибленими. Світло, падаючи на них, розсіюється, і в полі зору мікроскопа межі зерен здаються темними, а самі зерна – світлими.
Внутрішня структура зерна металу не є точно правильною. Металам властиві дефекти структури.
3. Сплав – суміш якого-небудь металу з одним або кількома іншими елементами.
 У рідкому стані більшість металів розчиняються один в одному і утворюють однорідний рідкий сплав. У процесі кристалізації з розплавленого стану різні метали поводять себе по-різному, що зумовлює існування таких трьох типів сплавів:
У рідкому стані більшість металів розчиняються один в одному і утворюють однорідний рідкий сплав. У процесі кристалізації з розплавленого стану різні метали поводять себе по-різному, що зумовлює існування таких трьох типів сплавів:
1) У твердому стані метали, що сплавляються, не розчиняються один в одному і хімічно не взаємодіють один з одним. За цих умов сплав є хімічною сумішшю і складається з кристалітів одного і другого компонентів, які чітко видно на мікрошліфі.
 2) Метали, які сплавляються, взаємодіють один з одним, утворюючи хімічну сполуку.
2) Метали, які сплавляються, взаємодіють один з одним, утворюючи хімічну сполуку.
3) У процесі кристалізації з розплаву розчинність металів один в одному зберігається. Утворюються однорідні кристали. У цьому випадку тверда фаза називається твердим розчином. При цьому для одних металів взаємна розчинність їх у твердому стані не обмежена, інші ж розчиняються один в одному лише до певних концентрацій.
Контрольні запитання:
- Охарактеризуйте загальні фізичні властивості металів.
- Методи вивчення кристалічної структури металів.
- Що називається сплавом? Типи сплавів.
- Масова частка натрію в його інтерметалічній сполуці з оловом дорівнює 20,5%. Визначте формулу інтерметалічної сполуки.
- Зразок сплаву заліза з вуглецем масою 7,27 г розчинили в сульфатній кислоті. Об’єм утвореного водню склав 2,8 л за н.у. Який сплав заліза був взятий? Визначте масову частку карбону в сплаві.
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. – Гл. ХVІ, §§ 190-191, 194, с. 530-538, 543 -553.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІ, Гл. 12, §§ 94-97, с. 108-110.
Тема 5.2. Одержання металів
1. Добування металів з руд. *
- Добування металів високої чистоти:
2.1. Перегонка у вакуумі. **
2.2. Зонне плавлення. **
2.3. Термічне розкладання летких сполук металів. **
1. Переважна більшість металів у природі знаходиться у вигляді сполук з іншими елементами. Тільки небагато металів трапляються у вільному стані, і тоді їх називають самородними. Золото і платина трапляються майже винятково в самородному вигляді, а срібло і мідь – почасти; іноді трапляються також самородні ртуть і деякі інші метали.
Золото і платину добувають або за допомогою механічного відокремлення їх від тієї породи, в якій вони містяться, або вилученням їх з породи різними реагентами з подальшим виділенням з розчину. Всі ж інші метали добувають хімічною переробкою їхніх природних сполук.
Мінерали і гірські породи, що містять сполуки металів і придатні для добування цих металів заводським способом, називаються рудами. Найголовніші руди містять оксиди, сульфіди і карбонати металів.
Пірометалургія охоплює способи отримання металів з руд за допомогою реакцій відновлення, що проводяться при високих температурах. В якості відновників використовують вугілля, активні метали, карбон (ІІ) оксид, водень, метан. В основі цього методи лежить реакція відновлення металу з його оксиду: Сu2O + C → 2Cu + CO.
У тих випадках, коли руда є сульфідом металу, її попередньо переводять в оксид шляхом окислювального обпалення, а потім оксид металу відновлюють вугіллям: 2ZnS + 3O2 → 2ZnO + 2SO2
ZnO + C → Zn + CO
Відновлення металів з їх сполук іншими металами, хімічно більш активними, при високих температурах називається металотермією. В якості відновників використовують алюміній (алюмінотермія), магній (магнійтермія), кальцій, натрій. Цим способом одержують ті метали, які при відновленні їх оксидів вугіллям утворють карбіди (Mn, Cr, Ti, Mo, W).
Гідрометалургія охоплює способи отримання металів з розчину їх солей. При цьому метал, який входить до складу руди, спочатку переводять в розчин за допомогою необхідних реагентів, а потім виділяють його з цього розчину. Цим методом добувають до 25% міді, золото, срібло, цинк. Кадмій, молібден, уран.
Електрометалургія охоплює способи отримання металів за допомогою електролізу. Цим способом одержують легкі метали з їх розплавлених оксидів або хлоридів: алюміній, натрій і т.д.
2. Протягом останніх десятиріч, у зв’язку з розвитком нових галузей техніки, виникла потреба в металах дуже високої чистоти. У зв’язку з потребами промисловості розроблено нові способи очищення речовин.
2.1. Перегонка у вакуумі. Цей спосіб ґрунтується на різниці в леткості металу, який очищається, і наявних у ньому домішок. Вихідний метал завантажують у спеціальну посудину, з’єднану з вакуум-насосом, після чого нижню частину посудини нагрівають. У процесі перегонки на холодних частинах посудини осідають або домішки (якщо леткість їх більша, ніж основного металу), або очищений метал (якщо домішки мають меншу леткість). Процес здійснюється при безперервному відкачуванні повітря, бо наявність навіть невеликої кількості кисню спричинила б окиснення поверхні розплавленого металу і тим самим загальмувала б процес випаровування.
2.2. Зонне плавлення полягає в повільному протягуванні бруска металу, який треба очистити, через кільцеву піч. Та ділянка (зона) бруска, яка перебуває в цей момент у печі, плавиться. В міру пересування бруска рідка зона переміщується від початку бруска до його кінця. Зонному плавленню підлягає метал, що пройшов попереднє очищення. Вміст домішок у ньому вже невеликий, так що основний метал і домішки утворюють гомогенний твердий розчин. Під час переміщення бруска через кільцеву піч відбувається плавлення металу біля передньої межі зони і кристалізація його біля задньої межі. При цьому склад кристалів, які утворилися і перебувають в рівновазі з розплавом, відрізняється від складу розплаву. Домішки одних металів концентруються в розплавленій зоні і переміщуються разом з нею до кінця бруска; домішки інших металів концентруються у кристалах, що утворилися, лишаються за рухомою зоною і при неодноразовому повторенні процесу переміщуються до початку бруска. Внаслідок цього середня частина бруска буде найчистішою; її вирізають і використовують.
2.3. Термічне розкладання летких сполук металу.
Карбонільний процес. Цей спосіб застосовують для добування високо чистих нікелю і заліза. Метал, який треба очистити, нагрівають в атмосфері СО, що знаходиться під тиском близько 20 МПа. При цьому нікель взаємодіє з СО, утворюючи леткий тетракарбоніл нікелю Ni(CO)4; домішки, які є у вихідному металі, в таку реакцію не вступають. Добутий Ni(CO)4 відганяють, потім нагрівають до вищої температури. Внаслідок цього карбоніл руйнується з виділенням високо чистого металу.
Йодидний спосіб. Дає змогу добувати титан, цирконій і деякі інші метали значної чистоти.
Пр.: Титан у вигляді порошку нагрівають до 100-200ºС з великою кількістю йоду в герметичному апараті. В апараті натягнуто титанові нитки, які нагріваються електричним струмом до 1300-1500С. Титан утворює з йодом леткий йодид TiI4 , який розкладається на розжарених нитках. Чистий титан, що при цьому виділяється, осідає на них, а йод утворює з вихідним металом нові порції йодиду; процес відбувається безперервно до перенесення всього металу на титанові нитки.
Контрольні запитання:
- Запропонуйте спосіб добування заліза. Наведіть рівняння реакцій.
- Складіть схему добування натрію з натрій хлориду.
- Запропонуйте шляхи добування міді з розчину купрум(ІІ) сульфату.
- Яку масу вольфраму можна добути шляхом алюмотермії з вольфрамової руди масою 1 т, вміст в якій WO3 складає 56%, якщо вихід продукту реакції дорівнює 80%?
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. – Гл. ХVІ, §§ 192-193, с. 538-542.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІ, Гл. 12, §98, с. 111-112.
Тема 5.3. Магній і берилій.
1. Положення в ПС і будова атома.
- Поширення в природі.*
- Добування магнію та берилію.*
- Фізичні властивості.
- Хімічні властивості.**
- Характеристика основних сполук.*
- Застосування.
| План характеристики | Берилій | Магній |
| Положення в ПС і будова атома | Розташовані в ІІ групі головній підгрупі, тому містять на зовнішньому енергетичному рівні 2 валентних електрони (ІІ валентність) | |
| Поширення в природі | Мало поширений в земній корі (0,0004%). Входить до складу деяких мінералів, з яких найчастіше зустрічається берил Be3Al2(SiO3)6. Деякі різновиду берилу належать до дорогоцінних каменів (ізумруди, аквамарини) | Досить поширений у природі (у земній корі близько 2%). У великій кількості він трапляється у вигляді карбонату магнію, утворюючи мінерали магнезит MgCO3 і доломіт MgCO3∙CaCO3. Сульфат і хлорид магнію входять до складу калійних мінералів – каїніту KCl∙MgSO4∙3H2O і карналіту KCl∙MgCl2∙6H2O. |
| Добування | Електроліз розплавів сполук берилію, найчастіше хлориду берилію. | Електроліз розплаву магній хлориду або безводного карналіту. |
| Фізичні властивості | Дуже твердий, крихкий, білий, легкий метал. | Сріблясто-білий, дуже легкий метал. |
| Хімічні властивості | Є сильними відновниками. Дещо менш активний берилій, що зумовлено утворенням на поверхні цього металу захисної оксидної плівки. 1. Взаємодія з простими речовинами: киснем, сіркою, галогенами, воднем, азотом, вуглецем, кремнієм (при нагріванні): 2Be + O2 → 2BeO Mg + S → MgS Be + H2 → BeH2 3Mg + N2 → Mg3N2 2. З водою берилій не взаємодіє, а магній лише при нагріванні Mg + 2H2O → Mg(OH)2 + H2 3. З кислотами З хлоридною та розведеною сульфатною кислотою утворюють солі і водень; Розведену нітратну кислоту метали відновлюють до аміаку або нітрату амонію 4. Взаємодія лугами Берилій утворює з водними розчинами лугів комплексні солі і водень: Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2 5. Магній може відновлювати багато металів з їх оксидів і солей: TiCl4 + 2Mg → Ti + 2MgCl2 | |
| Характеристика основних сполук | Оксид BeO і гідроксид Be(OH)2 проявляють амфортерні властивості | Оксид MgO - основні властивості; Mg(OH)2 - луг |
| Застосування | 1) у виготовленні віконець рентгенівських трубок, через які проміння виходить назовні 2) є легуючою добавкою сплавів.Сплави нікелю з берилієм застосовують для виготовлення пружин та хірургічних інструментів; сплави з алюмінієм або магнієм застосовують в авіабудуванні 3) гарний уповільнювач і відбивач нейтронів у високотемпературних ядерних реакторах | 1) у виготовленні сплавів: електрони (Mg – Al – Zn, Mg – Mn, Mg – Zn - Zr) застосовують в ракетній техніці та авіабудуванні, в авто-, мото-, приладобудуванні. 2) в металургії для добування металів 3) в сагнійорганічному синтезі |
Контрольні запитання:
- Способи добування магнію і берилію.
- У чому полягає відмінність у хімічних властивостях магнію і берилію та їх сполук?
- Здійсніть перетворення за схемою, назвіть речовини:
MgCl2 → Mg → MgSO4 → [Mg(OH)2]SO4 → Mg(OH)2 → MgO → Mg(NO3)2
- При взаємодії 19,5 г металу, що належить до ІІ-А групи періодичної системи елементів, з азотом утворився нітрид, при повному гідролізі якого одержали 47,125 г гідроксиду металу. Визначте метал.
- При термічному розкладі суміші магній оксиду та магній карбонату масою 58, 4 г одержали 32 г твердого залишку. Обчисліть масову частку магній оксиду у вихідній суміші.
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. – Гл. ХІХ, §§ 209-210, с. 607-614.
Тема 5.4. Алюміній і титан
1. Положення в ПС і будова атома.
- Поширення в природі.*
- Добування алюмінію і титану.*
- Фізичні властивості.
- Хімічні властивості.**
- Характеристика основних сполук.*
- Застосування.
| План характеристики | Алюміній | Титан |
| Положення в ПС і будова атома | Розташований в 3-ому періоді, ІІІ групі головній підгрупі, тому містить на зовнішньому енергетичному рівні 3 валентних електрони (ІІІ валентність) | Розташований в 4-тому періоді, IV-В групі. Має на зовнішньому шарі 2 електрони, а в передостанньому шарі – 10 електронів, з яких 2 на d-підрівні. Тому найхарактерніший с.о. +4 (+3 - рідше) |
| Поширення в природі | Найпоширеніший у земній корі (8%) метал. Входить до складу глин, польових шпатів, слюд і інших мінералів. Алюмінієві руди: нефелін Na2O∙Al2O3∙2SiO2 та алуніт K2SO4∙Al2(SO4)3∙2Al2O3∙6H2O, боксити. | Дуже поширений у природі (в земній корі 0,6%). Мінерали: титаномагнетити FeTiO3∙nFe3O4, ільменіт FeTiO3, сфен CaTiSiO5, рутил TiO2. |
| Добування | Електролітичним методом з досить чистого оксиду алюмінію | 1) Руду переводять у TiO2, який потім хлорують у присутності вуглецю: TiO2 + 2Cl2 + 2C → TiCl4 + 2CO Добутий TiCl4 відновлюють магнієм: TiCl4 + 2Mg → Ti + 2MgCl2, А суміш, що утворилася, нагрівають у вакуумі. При цьому магній і його хлорид випаровуються й осаджуються в конденсаторі. Губчастий титан переплавляють. 2) для добування невеликої кількості титану великої чистоти використовують йодидний метод. |
| Фізичні властивості | Сріблясто-білий метал, легкий метал. Його можна легко витягувати в дріт і прокатувати в тонкі листи. | Сріблясто-білий метал, міцний і пластичний, плавиться при 1668С, густина 4,5г/см3 |
| Хімічні властивості | Є активними металами, але на повітря вкриваються захисною плівкою. 1. Взаємодія з простими речовинами: киснем, сіркою, галогенами, воднем, азотом (при нагріванні): Ti + 2Cl2 → TiCl4 2Ti + N2 → 2TiN 4Al + 3O2 → 2Al2O3 4Al + 3C → Al4C3 | |
| 2. З водою не взаємодіє, але при видаленні оксидної плівки відбувається енергійна реакція: Al + 6H2O → 2Al(OH)3 + 3H2 3. З кислотами З хлоридною та розведеною сульфатною кислотою утворюють солі і водень; Нітратна і концентрована сульфатна кислоти пасивують метал. 4. Взаємодія лугами Алюміній утворює з водними | 2. З кислотами. В нітратній кислоті пасивується, а в хлорид ній і сульфатній розчиняється лише при нагріванні. Може розчинятися у фторидній кислоті з утворенням комплексної сполуки: Ti + 6HF → H2[TiF6] + 2H2 3. Стійкий до дії солей і лугів. | |
| розчинами лугів комплексні солі і водень: 2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2 5. Відновлює багато металів з їх оксидів: 2Al + Cr2O3→ Al2O3 + 2Cr | ||
| Характеристика основних сполук | Оксиди Al2O3, TiO2 і гідроксиди Al(OH)3, Ti(OH)4 проявляють амфотерні властивості | |
| Застосування | 1) виготовлення сплавів: дуралюміни (місять мідь і магній), силуміни (кремній), магналій (магній), які використовують у ракетній техніці, авіа-, авто-, судно- та приладобудуванні, у виробництві посуду 2) у виготовленні хімічної апаратури, електричних проводів. конденсаторів 3) добування металів (алюмотермія) 4) алітування | 1) у виготовленні сплавів 2) у виготовленні хімічної апаратури 3) в літако- і ракетобудуванні (жароміцність сплавів титану) |
Контрольні запитання:
- Порівняйте будову алюмінію і титану.
- Способи добування алюмінію і титану.
- У чому полягає відмінність у хімічних властивостях алюмінію і титану?
- Здійсніть перетворення за схемою, назвіть речовини:
Al → AlN → Al(OH)3 → Al(NO3)3→ Al2O3 → NaAlO2→ Al(OH)3
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 666; Нарушение авторских прав?; Мы поможем в написании вашей работы!