
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гібридизація атомних електронних орбіталей
|
|
|
|
Часто атом утворює зв’язки за рахунок електронів, що перебувають на різних енергетичних рівнях. Наприклад, атом берилію в незбудженому стані не містить неспарених електронів (1s22s2), тому щоб набути здатності до утворення хімічних зв’язків атом берилію повинен перейти у збуджений стан (1s22s12p1). У збудженому стані атом берилію має два неспарених електрони, розташованих на 2s i 2p-орбіталях. При цьому відбувається так звана гібридизація: вихідні форми електронних хмар (орбіталей) взаємно змінюються і утворюються хмари (орбіталі) нових інших форм.
На малюнку схематично зображено гібридизовану sp-орбіталь, яка виникла внаслідок комбінації хмар s i p-електронів. Гібридизована sp-хмара більш витягнута по один бік від ядра, тому хімічний зв’язок, утворений за рахунок гібридизованої хмари, повинен бути міцнішим, ніж зв’язок, що виник внаслідок перекривання окремих хмар s- i p-електронів.
Розглянутий випадок гібридизації однієї s- і однієї р-орбіталі, що приводить до утворення двох sp- орбіталей, називається sp-гібридизацією. sp-орбіталі орієнтовані у протилежних напрямках. Звідси хімічні зв’язки, утворені за їх участю, також розташовуються під кутом 1800, що зумовлює лінійну будову таких молекул, як ВеСІ2, BeF2 тощо.
Внаслідок комбінації хмар одного s- і двох р-електронів утворюються три гібридизовані хмари, розташовані одна відносно одної під кутом 1200. Під таким самим кутом розташовуються зв’язки, що виникли за їх участю. Внаслідок sp2-гібридизації молекула BСl3 має форму правильного плоского трикутника, в центрі якого розміщені атом бору, а у вершинах - атоми хлору.
Якщо в гибридизації беруть участь одна s- і три р-орбіталі (sp3-гібридизація), то утворюються чотири гібридизовані sp3-орбіталі, які орієнтовані в просторі симетрично відносно чотирьох вершин тетраедра, тобто під кутом 109028’.
Тетраедричне розташування зв’язків характерне для багатьох сполук, в яких вуглець проявляє валентність, що дорівнює чотирьом, наприклад СН4. Внаслідок sp3-гібридизації орбіталей атома азоту аналогічну структуру має також іон NH 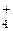 .
.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 718; Нарушение авторских прав?; Мы поможем в написании вашей работы!