
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа є сталою при даній температурі величиною і називається іонним добутком води
Процес розчинення міг би тривати до повного розчинення будь-якої кількості речовини, коли б одночасно не відбувався зворотній процес – кристалізація. Таким чином, процес розчинення відбувається до тих пір, поки не встановиться динамічна рівновага, при якій за одиницю часу розчиняється стільки ж молекул, скільки їх кристалізується з розчину.
Сумарний тепловий ефект процесу розчинення буде позитивним, або негативним залежно від того, що переважатиме: тепловий ефект сольватації, чи сума теплових ефектів дифузії і руйнування зв’язків між чатинками речовини, яка розчиняється.
Дифузія – рівномірний розподіл сольватованих частинок в розчиннику – цей процес супроводжується поглинанням теплоти.
Розчинення деяких речовин супроводжується виділенням теплоти, а інших, навпаки – поглинанням. Вперше пояснення цьому явищу дав Д.І.Менделєєв у своїй гідратній теорії розчинів.
Під час розчинення речовини відбуваються такі процеси:
3) зв’язок між частинками речовини (молекулами, атомами, іонами) руйнується – це супроводжується поглинанням теплоти;
2) розчинені частинки речовини, що розчиняється утворюють з молекулами розчинника відносно нестійкі сполуки які часто мають змінний склад і називають сольватами (якщо розчинником є вода – гідратами) це супроводжується виділенням теплоти;
(3)
Розчинність. Фактори, що впливають на розчинність.
Розчинність речовин - це здатність речовини розчинятися у воді або в інших розчинниках. Розчинність залежить від природи розчинника і розчиненої речовини, температури, тиску (для газів). З підвищенням температури розчинність багатьох як твердих так і рідких речовин збільшується. Розчинність газів у воді при нагріванні зменшується і залежить від тиску: чим вище тиск, тим краще розчинність.
Часто розчинність виражають числом одиниць маси безводної речовини, що насичує за певних умов 100 одиниць маси розчинника, і називають її коефіцієнтом розчинності.
Розчин, в якому взята речовина при даних умовах більше не розчиняється, називається насиченим. В насиченому розчині встановлюється динамічна рівновага. Розчин, в якому взята речовина ще може розчинитись при даних умовах, називається ненасиченим. Якщо обережно охолодити гарячий насичений розчин, можна одержати пересичений розчин. Пересичений розчин нестійкий. При зміненні умов починається кристалізація розчиненої речовини.
(4)
Концентрація. Способи вираження концентрації розчинів.
Основним параметром стану розчину крім температури і тиску є також - вміст розчиненої речовини в розчині - концентрація.
Концентрація - це кількість або маса речовини, що знаходиться у визначеному об’ємі або визначеній масі розчину або розчинника.
Розчини з великою концентрацією розчиненої речовини називаються концентрованими, з малою концентрацією - розбавленими.
Розглянемо найбільш часто використовані в хімії способи вираження концентрації розчинів.
Способ вираження Визначення
концентрації
Масова доля
Масова частка розчиненої речовини - w
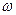 = = 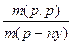
| це відношення маси розчиненої в Це відношення маси речовини
до загальної маси розчину.
Масова частка – безрозмірна величина. Її виражають в частках від одиниці, або в процентах.
Наприклад: 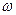 = 0,42 або 42% = 0,42 або 42%
|
| Молярна концентрація – См См = n/V n - кількість речовини; V – об ’єм розчину. | ЦЦе відношення кількості роз- Чиненої речовини до об’єму розчину. де Одиниця молярної концентрації - моль/л. Молярну концент-рацію позначають буквою См. Наприклад, запис 0,2 М означає, що молярна концентрація розчину 0,2 моль/л. |
Нормальна (еквівалентна концентрація)
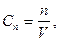 де
n -число еквівалентів,
V- об’єм розчину де
n -число еквівалентів,
V- об’єм розчину
| - це відношення числа еквіва число еквівалентів розчиненої речовини в певному об’ємі розчину. Одиниця нормаль-ної концентрації моль/л. Одиницю нормальної концентрації позначають буквою н. Запис 0,1н означає, що нормальна кон- ценрація дорівнює 0,1 моль/л. |
Вода, як дуже слабкий електроліт, в незначному ступені дисоціює, утворюючи іони водню і гідроксид-іони:
Н2О  Н+ + ОН-
Н+ + ОН-
Цьому процесу відповідає константа дисоціації:
К =  .
.
В розведених водних розчинах концентрація води мало змінюється, так що можна її вважати сталою величиною:
[H+][OH-] = K[H2O] = 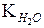 .
.
В чистій воді концентрації іонів водню і гідроксид іонів однакові і при 250С складають 10-7 моль/л. Розчини, в яких концентрація іонів водню і гідроксид іонів однакові, називаються нейтральними. Так, при 250С в нейтральному розчині [H+]=[OH-] =10-7 моль/л. В кислих розчинах [H+]>[OH-]; в лужних - [H+]<[OH-].
Замість концентрацій іонів H+ і OH- користуються їх десятковими логарифмами, взятими з оборотнім знаком рН і рОН і називаються відповідно водневим і гідроксильним показниками.
pН = - lg[H+]; pOH = - lg [OH-].
Логарифмуючи співвідношення [H+][OH-] = 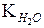 , одержуємо:
, одержуємо:
рН + рОН = р 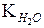 .
.
Зокрема, при 250С рН + рОН = 14. При цій температурі в нейтральних розчинах рН = 7; в кислих рН<7, в лужних рН>7.
|
|
Дата добавления: 2015-05-24; Просмотров: 499; Нарушение авторских прав?; Мы поможем в написании вашей работы!