
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ідентифікація невідомої органічної речовини. 2 страница
 |
1. Виявлення карбону і гідрогену методом спалювання речовини з купруму (II) оксидом.
2. Виявлення нітрогену, сульфуру і галогенів методом сплавлення речовини з металічним натрієм.
3. Виявлення оксигену.
III. Визначення розчинності у воді, розчинах лугів і кислот.
Примітка: для сполук, розчинних у лугах, насамперед необхідно провести реакцію з феруму (III) хлоридом, індофенолову реакцію
5.2. Схема дослідження невідомої органічної сполуки
і реакцію з нінгідрином. Якщо реакція з нінгідрином позитивна, то проводять реакції з формаліном, а потім з метиловим червоним (спосіб виявлення а-амінокислот).
Для сполук, розчинних у кислотах, насамперед проводять ізо-нітрильну реакцію, реакцію з нітритною кислотою й одержання азобарвника.
IV. Проба на лакмус.
V. Визначення функціональних груп.
1. Кратні зв'язки:
а) знебарвлення бромної води (у деяких випадках використовують розчин брому в тетрахлорометані);
б) реакція з калію перманганатом;
Примітка: розчин калію перманганату може окиснювати спиртовий гідроксил і альдегідну групу, тому до проведення цієї реакції вищезгадані групи треба попередньо захистити.
в) утворення ацетиленідів (реакція з амоніачним розчином купруму (I) хлориду або амоніачним розчином аргенту-му оксиду).
2. Ароматичні вуглеводні:
а) реакція нітрування;
б) реакція сульфування.
3. Нітрогрупа:
а) реакція з цинком і амонію хлоридом;б) реакція з натрію гідроксидом
Вопрос№4
Нітросполуки.Будова нітрогрупи. Одержання нітросполук. Хімічні і фізичні властивості нітросполук.
Нітросполуки-це органічні речовини, в молекулах яких є нітрогрупа -NO2, пов'язана з атомамивуглецю.
Будова нітрогрупи:
Нітрогрупа має плоску (планарну будову); атоми нітрогену та оксигену знаходяться в стані sp 2-гібридизації. Електронна будова може бути представлена у вигляді двох граничних структур, в яких один з атомів оксигену утворює з атомом нітрогену подвійний, а другий — семіполярний зв’язок.
|
|
|
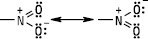
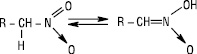
Залежно від природи вуглеводневого радикалу, з яким зв’язана нітрогрупа, розрізняють аліфатичні та ароматичні Н. За розміщенням нітрогрупи у вуглецевому ланцюгу Н. підрозділяють на первинні, вторинні й третинні. Назви Н. утворюють додаванням префікса нітро- до назви відповідного вуглеводню із зазначенням положення нітрогрупи у вуглецевому ланцюгу: CH3CH(NO2)CH2CH3 — 2‑нітробутан, C6H5NO2 — нітробензен, C6H5CH2CH2NO2 — 1-нітро-2-фенілметан. Аліфатичні Н. — безбарвні рідини, які мають приємний запах і переганяються без розкладання, мало розчиняються у воді, токсичні, не викликають корозії металів, їх водні розчини мають нейтральну реакцію, Tкип вища, ніж у спиртів або карбонільних сполук. Ароматичні мононітросполуки — висококиплячі рідини або тверді низькоплавкі речовини, безбарвні або світло-жовтого кольору, важчі за воду і в ній не розчиняються, мають запах гіркого мигдалю. Н., які містять рухливі атоми гідрогену біля атома карбону, є таутомерними сполуками (нітро-ацинітротаутометрія):
Одержання нітросполук:
Отримання
Нітрування алканів (Коновалов, Хесс). Алкани окислюються концентрованої азотної кислотою або сумішшю азотної та сірчаної кислот. Нітрування протікає тільки під дією розбавленої азотної кислоти пр нагріванні (М. І. Коновалов, 1888 р.): R-H + HO-NO2 R-NO2 + H2O Швидкість реакції невелика і виходи низькі
. Кращі результати виходять з алканами, що містять третинні вуглецеві атоми. Реакція супроводжується утворенням полінітросполук і окисними процесами. Практичне значення набули такі методи нітрування алканів: 1) в газовій фазі при 350-400 о С за допомогою 40-70% - іншої HNO3 (Нітрування по Хессу, 1936 р.),
|
|
|
2) в рідкій фазі при 100-200оС з 50-70% - іншої HNO3;
3) у рідкій або газовій фазі тетраоксидом або діоксидом азоту. У промисловості набуло застосування нітрування парами азотної кислоти при 250-500оС - парофазного нітрування. Вибір температури процесу залежить від дині вуглецевого ланцюга і будови вуглеводню: ізобутан реагує вже при 150оС, тоді як метан - при 3700С. Реакція супроводжується крекінгом вуглеводню, в результаті чого утворюються мононітроалкани з вуглецевим ланцюгом різної довжини (деструктивне нітрування). На реакцію нітрування витрачається близько 40% азотної кислоти, інша її частина діє як окислювач. Тому поряд з нітросполуками утворюються також спирти, кетони та кислоти. Крім того, утворюються і неграничні вуглеводні. Реакція нітрування - радикальний процес. Ланка ланцюга: RH + NO2 · R · R + NO2 R - NO2
Реакція Мейєра. CH3CH2Br + NaNO2 CH 3 CH 2 NO 2 + NaBr реакція Корнблюм Окислення амінів. Ніросполуки також можуть бути отримані окислюванням амінів: RСH2CH2NH2 RCH2CH2NO2 Алкілювання нітриту аргентуму. В. Мейєр 1872 р. розробив метод одержання нітроалканів при взаємодії галогеиалкілу з нітритом аргентуму:
CH3Br + AgNO2 CH 3 NO 2 + AgBr реакція Мейєра
29. Склад порохів. Залежність стійкості горіння пороху від структури його зерен. Димний порох.
По́рох -тверда система, яка містить органічні і неорганічні сполуки, здатні стійко (без переходу у детонацію) горіти у широкому інтервалі зовнішнього тиску (0,1-1000 МПа), виділяючи велику кількість газів з температурою 1200-3700 °С.
Для підвищення прогресивності горіння пороху обробляють з поверхні флегматизаторами. Згідно з патентами [1-3] при отриманні прогрессивногорящих сферичних порохів (СФП) в якості флегматизаторов використовують динітротолуол (ДНТ), централит 1, дибутилфталат (ДБФ) або їх суміші, за умови, що їх температура кристалізації на 20-30°C нижче температури кипіння води, оскільки флегматизація СФП здійснюється у водному середовищі при підвищених температурах емульсіями компонентів. Кожен флегматизатор має свої переваги і недоліки, і жодна з них не є універсальним. Так, централит 1, закордонного виробництва, в індивідуальному вигляді застосовується тільки для флегматизации двоосновний СФП (що містять нітрогліцерин) з-за низької пластифікуючої здатності по відношенню до нітратів целюлози (НЦ). Для одноосновних СФП він використовується тільки в суміші з ДНТ або з ДБФ, що виконують функцію пластифікаторів НЦ.
|
|
|
Ди́мний по́рох — механічна суміш сірки, калієвої або натрієвої селітри та деревного (вільхового) вугілля являє собою зерна одноманітного чорного або сірого кольору зі слабко блискучою поверхнею.
30. Поняття про хімічні, фізико-хімічні і фізичні методи аналізу. Особливості фізико-хімічних методів аналізу. Клачифікація фізико-хімічних методів аналізу.
Висока чутливість фізико-хімічних методів
аналізу робить їх незамінними у виробництві речовин високої і надвисокої
чистоти, абсолютно необхідних сучасній науці і техніці, вони можуть
забезпечити достатньо надійне визначення домішок у кількості 10-8
-10-10 %.
Якщо звичайними хімічними методами можна визначити концентрацію
речовини 10-5 моль/л, то для деяких фізико-хімічних методів визначуваний
мінімум менший приблизно на 5 порядків, тобто 10-9
- 10-10моль/л.
Тут також допомагають ФХМА, другою
важливою перевагою яких є їх експресність, а також швидкість, з якою
проводиться визначення: в багатьох випадках – це секунди, за які можна
оцінити положення стрілки на шкалі пристрою. Багато приладів дозволяють
автоматизувати сам процес аналізу або деякі його стадії: автоматичні
газоаналізатори контролюють склад повітря в шахтах; автоматизований
газохроматографічний аналіз в нафтохімічній, коксохімічній і інших галузях
промисловості.
Під хімічним аналізом розуміємо сукупність дій, які мають на меті отримання інформації про хімічний склад об’єкту
Фізичні методи аналізу– сукупність методів якісного і кількісного аналізу речовин, що базується на вимірюванні фізичних характеристик, які зумовлюють хім. індивідуальність компонентів.
Ана́ліз фі́зико-хімі́чний — метод дослідження перетворень речовини, заснований на вивченні залежності між величинами, що характеризують фізичні властивості рівноважної системи, та її хімічним складом.
|
|
|
7.Шестиланкові гетероциклічні сполуки. пиридии. будова.піридин і його властивості.найважливіші природні та синтетичні пішохідні піридину.Найважливіші природні сполуки цих гетероциклів
Алкалоїди – велика група природних азотомістких сполук основного характеру, які мають сильні фармакологічні властивості. Слово “алкалоїд” походить від арабськогоalkali – луг і грецького – eidos - вид, подібний, тобто подібний лугам. Серед природних фармакологічно активних речовин алкалоїди представляють основну групу, з якої сучасна медицина отримує найбільшу кількість високоефективних лікарських засобів.
Класифікація. Алкалоїди відрізняються за хімічною структурою, за шляхами утворення та за фармакологічною активністю. Універсальної класифікації алкалоїдів не існує, але їх можна розділити, поклавши за критерій якусь певну ознаку. Академік Орєхов О.П. запропонував хімічну класифікацію, в основі якої лежить природа гетероцикла. Ця класифікація була опрацьована та розвинута іншими вченими і її широко використовують в хімії та фармакогнозії. Виділяють такі основні групи алкалоїдів:
1. Група пірролідина – невелика група справжніх алкалоїдів; їх представник – нікотин, який міститься в табаку та махорці; стахердин (чистець буквецецвітний).
пірролідін
2. Група піперидина та піредина – широко розповсюджена група справжніх алкалоїдів. До цієї групи належать анабазин (анабазис безлистий), лобелін (лобелія одутла).
піридин піперидин
3. Група з конденсованими пірролідиновими і піперединовим кільцями (похідні тропану) зустрічаються в обмеженій кількості родин. Найбільше їх міститься в родині пасльонових. До цієї групи алкалоїдів належать гіосциамін, атропін, скополамін, які є в блекоті чорній, дурмані звичайному, беладоні звичайній.
10. Група дигідроіндола (беталаіни) – єдина група алкалоїдів, яка має яскраве забарвлення. Найбільш відомий бетанідин, що міститься в коренях столового буряка.
11. Група пурину невелика група справжніх алкалоїдів; їх представник кофеїн (листя чаю, насіння кави).
пурин
12. Група імідазолу – це група справжніх алкалоїдів. До цієї групи належить пілокарпін (види пілокарпусу).
імідазол
13. Група акрідіну - це група справжніх алкалоїдів. До цієї групи належать акроніцин, мелікопін (рослини родини рутові).
акрідін
14. Група стероїдних алкалоїдів – порівняно велика група алкалоїдів, які належать до псевдоалкалоїдів. В основі структури цих алкалоїдів лежить скелет циклопентанапергідрофенантрена. Стероїдні алкалоїди мають властивості стероїдних сапонінів і алкалоїдів. В природі зустрічаються у формі глікозидів. Вони мають гемолітичні, поверхнево-активні і поряд з цим – основні властивості. До цієї групи алкалоїдів належать соласодін (посльон дольчастий), який використовується для синтезу гормональних препаратів типу кортизону.
15. Група терпенових алкалоїдів належить до псевдоалкалоїдів. Ізопренові залишки, які приймають участь в побудові псевдоалкалоїдів, належать до моно-, сескві-, ди-, та тритерпеноїдів. До цієї групи алкалоїдів належать аконітинові алкалоїди, які широко розповсюджені в родах аконіт і живокість.
16. Група алкалоїдів без гетероциклів (протоалкалоїди) низькомолекулярні відносно прості сполуки, які містять азот у бічному ланцюгу. Вони зустрічаються досить часто в рослинах різних родин. До цієї групи належать ефедрин (ефедра хвощевидна), капсаіцин (стручковий перець).
Якісне визначення алкалоїдів
1. Екстракція
1,0 г подрібненої та просіяної крізь сито з діаметром отворів 2 мм сировини поміщають в колбу зі шліфом на 100 мл, заливають 25 мл 1% розчину соляної кислоти та нагрівають на киплячій водяній бані протягом 30 хвилин, періодично помішуючи.
2. Якісні реакції
На предметне скло наносять краплину одержаного фільтрату та краплину реактиву і сполучають їх скляною паличкою. При наявності алкалоїдів на місці стикання крапель одразу ж або через деякий час утворюється осад або каламуть. Найчастіше застосовують розчини йодиду – йодиду ртуті, йодиду вісмуту в йодиді калію; фосфорно-молібденової, фосфорно-вольфрамової та пікринової кислот, свіжеприготовлений розчин таніну та ін.
1. Реактив Майєра (розчин дихлориду ртуті та йодиду калію).
2. Реактив Вагнера та Бушарда (розчин йоду в розчині йодиду калію) з підкисленими розчинами солей алкалоїдів утворює бурі осади, що являють собою сполуки гідройодидів алкалоїдів з йодом.
3. Реактив Драгендорфа (розчин нітрату вісмуту основного, йодиду калію та оцтової кислоти) з більшістю алкалоїдів в кислих розчинах дає оранжево-червоний або цегляно-червоний осади.
4. Реактив Марме (розчин йодиду кадмію в йодиді калію) з алкалоїдами утворює білі або жовтуваті осади, які часто розчиняють в надлишку реагенту.
5. Розчин таніну з солями алкалоїдів утворює білуваті або жовтуваті аморфні осади.
6. Розчин пікринової кислоти (1% водний) з багатьма алкалоїдами утворює жовті осади пікратів.
7. Реактив Зонненштейна (розчин фосфорномолібденової кислоти) з багатьма алкалоїдами утворює жовтуватий аморфний осад.
Алкалоїди - це азотомісткі органічні сполуки основного характеру. Вони відносяться переважно до гетероциклічних з'єднань з азотом в кільці, рідше азот укладений в бічний ланцюг. Виробляються в основному рослинами і володіють сильним специфічним дією. Концентруються в різних органах. Алкалоїди розчинені в клітинному соку рослин і утворюють солі з органічними кислотами: щавлевої, яблучної, лимонної, винної: в деяких рослинах вони з'єднуються зі специфічними кислотами, наприклад з меконовой кислотою в опійної маці, з хінной- в Хінном дереві.
8.особливості будови. класифікації адкалоідів.Якісні реакції на алкалоіди.фізіологічна дія адкалоідів на організм людини.Найважливіші алкалоіди, морфін,кодеін,ітд
Будова та властивості гетероциклічних сполук
Більшість гетероциклічних сполук - біологічно активні природні сполуки. Знання їх будови та властивостей необхідні для розуміння процесів обміну речовин в організмі. Деякі з них входять до складу білків, ферментів, вітамінів, нуклеїнових кислот, інші утворюються в організмі внаслідок перетворення та розщеплення складних речовин в процесі травлення. До гетероциклічних сполук відносяться алкалоїди - азотовмісні сполуки рослинного походження. Похідні їх набули великого значення в лікарській практиці. На основі гетероциклів синтезовано багато медичних препаратів (амідопірин, фурацилін, анальгин
Класифікація гетероциклічних сполук
Гетероциклічні сполуки – це органічні сполуки, що містять в своїх молекулах цикли, в яких крім атомів Карбону є атоми інших елементвв (гетероатоми).
Найбільш поширені в природі п*яти- и шестичленні цикли, в склад яких входять атоми азоту, кисню або сірки.
Залежно від природи гетероатома бувають нітроген-, оксиген- і сульфуровмісні цикли.
За ступенем насичення всі гетероцикли можуть бути насиченими, ненасиченими і ароматичними.
Піридин
Піридин С5H5N – шестичленний гетероцикл з одним атомом азоту.
Це безколірна рідина з неприємним запахом, т.кип. 115°С. Добре розч. в воді і органічних рідинах. Отруйний.
Електронна будова молекули піридина схожа до будови бензола. Атоми карбону і нітрогену знаходяться в стані sp2-гібридизації. Всі σ-зв’язки C–C, C–H і C–N утворені гібридними орбіталями, кути між ними складають приблизно120°. Тому цикл має плоску будову. Шість електронів, що знаходяться на негібридних р-орбіталях, утворюють π-електронну ароматичну систему.
З трьох гібридних орбіталей атома азоту дві утворюють σ-зв'язки С-N, а третя містить неподільну пару електронів, які не беруть участь в π-електронній системі. Тому піридин, подібно амінів, проявляє властивості основи. Його водний розчин забарвлює лакмус у синій колір. При взаємодії піридину з сильними кислотами утворюються солі пірідінія.
Поряд з основними властивостями піридин проявляє властивості ароматичного з'єднання. Однак його активність в реакціях електрофільного заміщення нижче, ніж у бензолу. Це пояснюється тим, що азот як більш електронегативний елемент відтягує електрони на себе і знижує щільність електронної хмари в кільці, особливо в положеннях 2, 4 і 6 (орто-і пара-положення).
Як і бензол, піридин може приєднувати водень у присутності каталізатора з утворенням насиченого з'єднання піперідіна.
Піперидин проявляє властивості вторинного аміну (сильне підстава).
Піперидинове кільце входить до складу одного з найбільш ефективних анастетіків-промедолу.
Піперидинове і піридинові ядра зустрічаються в багатьох алкалоїдах. Важливі похідні піримідину-деякі вітаміни групи В, нікотинова кислота і нікотинамід.
Нікотинова кислота.
Никотинова кислота або вітамін В3 і її похідна нікотинамід використовується організмом в процесі перетворення їжі в енергію. Никотинова кислота міститься в багатьох видах продуктів. Дієтичний дефіцит никотинової кислоти, пелагра, спостерігається досить рідко.
13.Реакції морфіну,кодеїну,героїну.Загальноалкалоїдні реакції на морфін та кодеїн і реакції пов`язані з функціональними групами цих алкалоїдів.Визначення опіатів методом тонкошарової хроматографії.
Морфін
Кольорові реакції. Морфін дає реакції з концентрованою азотною кислотою (криваво-червоне, що переходить в оранжево-жовте). З реактивом Ердмана (концентрована сірчана кислота з концентрованою азотною кислотою) дає червоно-жовте забарвлення. З реактивом Фреда (концентрована сірчана кислота з молібденовою кислотою) дає фіолетове забарвлення. З реактивом Манделіна (концентрована сірчана кислота з ванадієвою кислотою) дає фіолетове забарвлення. З реактивом Марки (концентрована сірчана кислота і формальдегід) дає фіолетове забарвлення.
Реакція Пелагрі. При нагріванні морфіну з концентрованими соляною та сірчаною кислотами він перетворюється на апоморфін, який дає позитивну реакцію Пелагрі. Виконання реакції Пелагрі на морфін дещо відрізняється від способу виконання цієї реакції на апоморфін. При виконанні реакції Пелагрі на морфін і кодеїн їх переводять до апоморфіну шляхом нагрівання з концентрованими соляною та сірчаною кислотами, а потім додають решту реактивів, необхідних для протікання цієї реакції.
Виконання реакції. У пробірку вносять кілька крапель хлороформної витяжки, яку випарюють насухо. До сухого залишку додають 1-2 краплі концентрованої соляної кислоти. Після розчинення сухого залишку в цій кислоті в пробірку вносять 1-2 краплі концентрованої сірчаної кислоти і суміш нагрівають на водяній бані до повного випаровування соляної кислоти. Після цього рідину ще нагрівають протягом 15 хв, потім охолоджують і додають 2-3 мл води. Якщо при цьому утворюється осад, то його розчиняють у кількох мілілітрах розведеної соляної кислоти. Отриманий розчин нейтралізують 10%-м розчином карбонату натрію і додають 2-3 краплі спиртового розчину йоду. При цьому з'являється зелене забарвлення. Після додавання 0,5-1,0 мл діетилового ефіру та збовтування водний шар зберігає зелене забарвлення, а ефірний набуває пурпурово-червоного. Надлишок йоду заважає цій реакції, так як його забарвлення маскує забарвлення кінцевого продукту реакції. У реакцію Пелагрі дають і інші речовини (кодеїн, етілморфін, діацетіл морфін, апоморфін та ін.)
Реакція з йодноватною кислотою (HIO3). При збовтуванні розчину морфіну, слабо підкисленою сірчаною кислотою, з розчином йодноватної кислоти або розчином йодату калію (KIO3), що не містить йодидів, виділяється вільний йод, який при збовтуванні з хлороформом переходить в хлороформний шар, фарбуючи його у фіолетовий колір.
У цю реакцію дають і деякі домішки, які переходять в хлороформну витяжку при виділенні морфіну з біологічного матеріалу. Тому реакцію з HIO3 можна застосувати для виявлення морфіну в препараті і сумішах лікарських речовин, а також у добре очищених витяжках з біологічного матеріалу.
Реакція з гексаціаноферратом (III) калію і хлоридом заліза (III). Ця реакція заснована на тому, що гексаціаноферат (III) калію окисляє морфін і перетворюється на гексаціаноферат (II) калію, який взаємодіє з хлоридом заліза (III). При цьому утворюється берлінська блакить, що має синє забарвлення. Реакцію з гексаціанофератом (III) калію виконують так: до водного розчину досліджуваної речовини додають кілька крапель суміші розчинів гексаціаноферата (III) калію і хлориду заліза (III). При наявності морфіну з'являється синє забарвлення або такого ж кольору осад.
У цю реакцію дають і деякі домішки, які з біологічного матеріалу переходять у алкалоідні витяжки. Тому реакцію з гексаціанофератом (III) калію застосовують для виявлення морфіну в лікарських сумішах і в добре очищених витяжках з біологічного матеріалу.
Кокаін
реакція Ерліха. Крапельний аналіз зразків проводиться криміналістами за допомогою реактиву, який готують розчиненням 0,5 г п-диметиламінобензальдегіду в 50 мл суміші, що складається з етанолу і концентрованої сірчаної кислоти, взятих у співвідношенні 3: 2 (за обсягом). При проведенні випробувань кілька крапель індикаторного розчину, який може довго зберігатися в герметично закритій темній склянці, додають до кількох міліграмам досліджуваного об'єкта, поміщеного в порцелянову чашку, після чого суміш нагрівають до 100 ° C і витримують при цій температурі 3 хв. Наявність кокаїну встановлюють по появі червоного фарбування
Кодеін
При взаємодії кодеїну з реактивами Драгендорфа, Бушарда, Майєру і іншими утворюються осідання. Кольорові реакції. Кодеїн з реактивами Манделіна, Марки і Фреде дає забарвлені продукти реакції, які описані вищим (див. гл. V,§ 7). Реакція Пеллагрі. При нагріванні кодеїну з концентрованою соляною кислотою, а потім з концентрованою сірчаною кислотою відбувається деметоксилірованіє цього алкалоїду і утворюється апоморфін, який дає реакцію
14.Похідні барбітуровової кислоти.Будова барбітуровової кислоти;синтез барбітуратів;застосування барбітуратів у медицині.Фізіологічний вплив барбітуратів на організм людини.Методи швидкого визначення барбітуратів.Визначення барбітуратів реаентом.
Похідні барбітурової кислоти
Барбітурова кислота являє собою циклічний уреід - який одержують шляхом конденсації сечовини з двохосновною малоновою кислотою.
Вона має кислі властивості за рахунок воднів метиленової і імідних груп, які можуть заміщатися на метали.
Барбітурова кислота сама не являється лікарським препаратом, але може давати велику кількість похідних, більшість з яких одержуються за рахунок заміщення воднів метильної групи різними радикалами.
В зв'язку з цим одержано велику кількість терапевтично активних лікарських препаратів, головним чином снодійних засобів. деякі барбітурати поряд із снодійною дією проявляють проти судомну дію (фенобарбітал), інші використовуються як наркотичні засоби (гексенал).
Маючи в основі своєї структури барбітурову кислоту, барбітурати відрізняються між собою характером радикалів в метальній групі і характером замісників при №2 і №2.
Барбітурати як лікарські препарати існують або у вигляді натрієвих (однозаміщених) солей (барбітал-натрій, барбаміл, етамінал-натрій, гексенал) або в кислотній формі (барбітал, фенобарбітал).
Існують і тіобарбітурати, у яких в 2-му положенні цикла кисень заміщення на сірку наприклад препарат тіопентал-натрій.
Поскільки барбітурати відрізняються один від одного, в основному характером радикалів (R, RI), а основна частина молекули у них однакова, то вони мають багато спільного як в методах одержання, так і в фізичних, хімічних властивостях і методах аналізу.
Загальний метод одержання барбітуратів заключається в тому, що одержання їх проводять в два етапи. На першому етапі одержують відповідний ефір малонової (або ціаноцтової) кислоти. На другому етапі синтезу здійснюється конденсацією вказаних ефірів із сечовиною.
Одним з перших барбітуратів був одержаний барбітал у 1904 році Е.Фішером. Барбітал одержують за схемою:
В залежності від характеру радікала для кожного барбітурати можуть бути різні варіанти синтезу.
Барбітурати - дрібнокристалічні білі порошки. Кислі форми барбітуратів (барбітал, фенобарбітал) мало розчинні у воді, але розчинні в органічних розчинниках, розчинах лугів, карбонатів. Барбітурати - солі добре розчинні в воді.
Барбітурати - клас седативних препаратів, які використовуються в медицині для зняття синдромів занепокоєння, безсоння і судомних рефлексів. Всі ці препарати є похідними барбітурової кислоти.
Хімічне ім'я барбітурова кислота, або малонілмочевіна.
На вигляд речовина являє собою безбарвні кристали, погано розчинні в холодній воді.
Хімічна формула: CONHCOCH2CONH
Синоніми і сленгові назви: англійські: barbiturates, barbies, downers, blues, seccies, nembies
Історія
Вперше барбітурова кислота була синтезована в 1863 році відомим хіміком Адольфом фон Байєром (Baeyer, Adolf von 18351917). Оскільки відкриття довелося на 4 грудня день Св. Барбари звідси відбулася перша частина назви кислоти. Друга ж частина від англійського слова В«ureaВ» - тобто В«сечаВ».
Широко використовуватися в медицині барбітурати почали з 1903 року, коли на ринок в якості заспокійливого і снодійного засобу був випущений препарат барбітал (Зареєстроване торгова назва Veronal). Незабаром препарат отримав досить широке поширення. Використання барбіту ратов в медичній практиці зростало аж до середини 1960х років, однак почало знижуватися в наступні роки.
Барбітурати успішно допомагали боротися з безсонням, так що недоліку в охочих їх спробувати не було. Однак, із зростанням популярності препарату, росло і число випадків негативних ефектів у тому числі і випадків наркотичної залежності. Ці наслідки і призвели до спаду застосування барбітуратів в медицині. Останнім часом їх все частіше замінюють більш безпечними бензодіазепінами. Тим не менш, барбітурати, як швидкодіючі засоби, до цих пір використовуються для термінової анестезії, а також для зняття судом і запобігання епілептичних нападів. Зараз до класу барбітуратів зараховується понад дві тисячі різних сполук, хоча в медичних цілях використовується лише деякі з них. Зазвичай назви препаратів цього класу закінчується на В«алВ». Найбільш поширеними є такі препарати, як фенобарбітал, бензобарбітал, люмінал, секонал, нембутал, а також транквілізатори либриум, валіум теразін.
Синтезують барбітурати звичайно конденсацією дизаміщених малонових або ціанооцтових ефірів із сечовиною або диціанамідом у присутності натрію алкоголяту в розчині абсолютного спирту. Барбітурати — білі кристалічні речовини або біла піноподібна маса (гексенал), або суха пориста маса жовтуватого кольору зі своєрідним запахом (тіопентанал-натрій), гіркі на смак. Барбітурати — кислоти, практично нерозчинні або малорозчинні у воді, розчинні або важко розчинні у спирті та інших органічних розчинниках, легко розчинні в розчинах лугів. Солі гігроскопічні, розчинні або легкорозчинні у воді та спиртах, практично нерозчинні в етерах. Для підтвердження тотожності барбітуратів проводять реакції утворення комплексних солей з катіонами важких металів, утворення солей дизаміщених похідних оцтової кислоти, реакції конденсації та реакції на функціональні угруповання. Натрієві солі ідентифікують за іонами Na+ та Тпл кислотної форми. Для кількісного визначення використовують методи кислотно-основного титрування,аргентометрію (для кислотної або сольової форми) та гравіметрію для кислотних форм.
Барбітурати діють на пацієнтів як за наявності порушень сну, так і без них. Вони викликають скорочення ФШС і дельта-сну, порушують ритмічність циклів сну. Приймаючи барбітурати, внаслідок пригнічення фази швидкого сну, відповідального за модуляцію інтелектуальномнестичних і емоційних процесів, хворі відзначають погіршення запам'ятовування, втрату гостроти сприймання, гнучкості і рухливості психічних процесів. До того ж, навіть після одноразового прийому барбітуратів спостерігається постгіпнотичний ефект (запаморочення, слабкість, непевна хода, недоладне мовлення, нудота тощо), який посилюється при повторному застосуванні. Після безсонної ночі хворий робить менше помилок, ніж після ночі з прийманням барбітурату перед сном. Снодійний ефект зумовлений впливом їх на проведення збудження в численних синапсахрізноманітних структур мозку. Точками впливу є кора великого мозку, сітчастий утвір, гіпоталамус, лімбічна система, таламус, у яких відбувається недиференційоване гальмування у вигляді мікронаркозу. Останнім часом доведено існування специфічних барбітуратних рецепторів (вважають, що вони, як і бензодіазепінові рецептори, входять до комплексу ГАМК-рецепторів), стимуляція яких підвищує чутливість ГАМК-рецепторів. Таким чином підвищується активність ендогенної синаптичної ГАМК.
ПРИНЦИП ДІЇ
Кожна смужка має зону зразку, просочену кон’югатом антитіло-колоїдальне золото та мембрану, просочену кон’югатом наркотичної речовини та контрольним реагентом. Зразок сечі реагує з кон’югатом антитіло-колоїдальне золото, а далі, за допомогою капілярного ефекту, мігрує вздовж смужки до тестової зони. Якщо у зразку сечі міститься достатня кількість наркотичної речовини, вони захоплюється кон’югатом та запобігає захопленню кон’югатом наркотичної речовини на мембрані у тестовій зоні. Незахоплений кон’югат продовжує міграцію вздовж тестової смужки до контрольної зони, де він захоплюється контрольним реагентом, формуючи червону смугу. Контрольна смуга свідчить про те, що результат є дійсним.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1508; Нарушение авторских прав?; Мы поможем в написании вашей работы!