
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Робота 3. Розрахувати ДР запропонованої викладачем солі
|
|
|
|
Робота 2. Вивчити вплив температури на процес гідролізу.
В пробірку налити 2 мл розчину ацетату натрію з концентрацією 0,1 моль/л і додати 2-3 краплі індикатора фенолфталеїну. Звернути увагу на забарвлення розчину. Розчин нагріти до кипіння. Що спостерігається? Обережно охолодити пробірку в холодній воді. Зробити висновок про вплив температури на процес гідролізу.
Кожна ланка (2-3 студентів) одержує від викладача завдання розрахувати ДР конкретної солі [AgCl, Ag2CrO4, BaSO4, Ca3(PO4)2, Mg(OH)2, CaCO3, Fe(OH)3, CaSO4] за наступною схемою:
а) записати рівняння реакції дисоціації:
AgCl ↔ Ag+ + Cl-
тверда фаза насичений розчин
б) рівняння константи рівноваги:

в) враховуючи, що тверда фаза не входить у рівняння константи рівноваги, тоді дістанемо:
Ks = [Ag+][Cl-]
У насиченому розчині малорозчинного електроліту при певній температурі добуток молярних концентрацій йонів є величиною сталою. Цю константу називають добутком розчинності.
ДР(AgCl) = Ks = [Ag+][Cl-]
Якщо відомо, що концентрація насиченого розчину AgCl при 250С 1,86*10-3 г в 1 л, то визначаємо молярну концентрацію розчину:
М(AgCl) = 143,3 г/моль 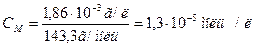
Із кожного моль AgCl маємо 1 моль/л [Ag+] і 1 моль/л [Cl-]
Тоді добуток розчинності:
ДР(AgCl) =(1,3*10-5)2 = 1,78*10-10 моль2/л2
Якщо записувати для електроліту у загальному вигляді.
AmBn↔mA++ nB-
ДР(AmBn) = [A+]m∙[B-]n
За даною схемою розрахувати ДР для запропонованої вам солі і зробити відповідний висновок.
Заняття 10
Тема: Буферні системи, класифікація та механізм дії.
Актуальність теми: Буферні системи є необхідними компонентами для існування живих організмів. У крові і інших біологічних рідинах є відповідні буферні системи, що підтримують майже стале значення рН. Знання складу буферних розчинів, механізму підтримання його рН, має важливе значення для розуміння механізмів дії буферних систем і регулювання основних фізіологічних процесів в організмі.
|
|
|
Навчальні цілі:
Знати: склад основних буферних систем організму, механізм їх дії, вплив на них кислотних і основних факторів.
Вміти: готувати буферні розчини, розраховувати значення рН цих розчинів за їх складом та розраховувати співвідношення компонентів буферного розчину за заданим значенням рН.
Самостійна позааудиторна робота студентів.
1. Дати визначення буферних систем, вказати їх хімічний склад.
2. Механізм дії буферної системи на прикладі ацетатного буферу.
3. Фактори від яких залежить рН буферних систем.
3. Вплив розведення буферних систем на рН.
4. Формули для визначення активної кислотностіаболужності буферних розчинів.
5. Механізм дії буферних розчинів:
а). гідрокарбонатного буферу;
б) фосфатної буферної системи;
в) білкових буферних систем.
6. Приготування буферних розчинів за даним значенням рН і розрахунок рН буферу за відомим співвідношенням компонентів буферної системи.
7. Буферні криві та їх характер.
8. Буферні системи крові.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 514; Нарушение авторских прав?; Мы поможем в написании вашей работы!