
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типи хімічного зв’язку
|
|
|
|
Ковалентний зв'язок - хімічний зв'язок, що виникає за рахунок усуспільнення електронної пари за обмінним механізмом, коли кожен з атомів постачає по одному електрону, або за донорно-акцепторним механізмом, якщо електронна пара передається у спільне користування одним атомом (донором) іншому атому (акцептору). Розрізняють ковалентний неполярний та полярний зв'язок.
Йонний зв'язок - окремий випадок ковалентного, коли спільна електронна пара повністю належить більш електронегативному атому.
Металічний зв'язок виникає в результаті часткової делокалізації валентних електронів, які досить вільно рухаються в гратці металів, електростатично взаємодіючи з позитивно зарядженими йонами.
Згідно з методом валентних зв’язків (МВС) хімічний зв'язок утворюється при перекриванні орбіталей, на яких розміщуються валентні електрони.При цьому можливі наступні способи перекривання деяких орбіталей:
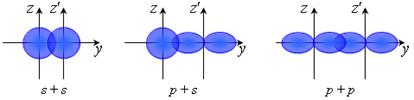
Такий спосіб перекривання називається σ-зв’язком - область перекривання лежить на лінії, яка з’єднує центри атомів.
Інший спосіб перекривання орбіталей,

який називається π-зв’язком - область перекривання лежить по обидві сторони від лінії, яка з’єднує центри атомів.
Для пояснення рівноцінності зв’язків у молекулах, для яких перекриваються нерівноцінні s-s та s-p -орбіталі, введено поняття про sp-, sp2-, sp3- гібридизацію.
У молекулі BeCl2 хімічні зв’язки утворюються внаслідок перекривання двох гібридних орбіталей атома Берилію та орбіталей атомів Хлору. Такий тип гібридизації називають sp- гібридизацією. Розглянемо схему перекривання орбіталей у молекулі BeCl2.
Електронна формула берилію – 4Be …2s2,
Розподіл електронів зовнішнього енергетичного рівня по квантових комірках:
|
|
|
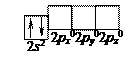
У даному стані, який називається незбудженим, валентність берилію рівна нулю, тобто немає неспарених електронів, здатних утворювати хімічні зв’язки. У сполуках берилій двовалентний внаслідок можливості розпаровування s- електронів зовнішнього енергетичного рівня і розміщення їх на р -орбіталі.
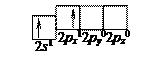
Розпаровування відбувається завдяки енергії, яка виділяється при хімічній взаємодії берилію, атом останнього переходить у так званий „збуджений стан“. Отже, збудження атомів – це розпаровування електронів у межах одного енергетичного рівня. Встановлено, що хімічні зв’язки, які утворюються завдяки цим двом електронам на відповідних орбіталях – рівноцінні. Це означає, що відбувається вирівнювання хвильових функцій 2 s- і 2р -орбіталей. Замість індивідуальних s- та р -орбіталей виникають дві однакові орбіталі – гібридні орбіталі, які в просторі мають форму несиметричних вісімок і розташовуються під кутом 180° одна відносно одної.
Схематично процес sp- гібридизації показаний нижче:

Гібридні орбіталі відрізняються від вихідних як за формою, так і за запасом енергії.
Електронну формулу зовнішнього енергетичного рівня атома Хлору записують таким чином:
17Cl... 3s23px13py23pz2
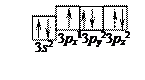
Валентним є 3px1 -електрон. Хімічні зв’язки утворюються завдяки перекривання двох sр -гібридних орбіталей атома Берилію та 3рх -орбіталей атомів Хлору.
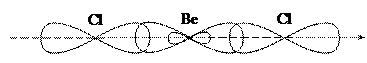
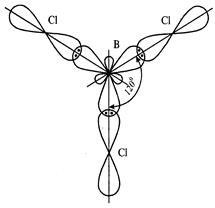
У молекулі BСl3 зв’язки утворюються при перекриванні трьох гібридизованих орбіталей атома Бору, з орбіталями атомів Хлору. Електронна формула Бору – 5B 1s22s22p1, розподіл електронів зовнішнього енергетичного рівня по квантових комірках:

Валентність атома Бору в незбудженому стані рівна одиниці (за кількістю неспарених електронів). Внаслідок розпаровування електронів розподіл електронів по квантових комірках для атома Бору у збудженому стані записується так:
|
|
|

У результаті Бор стає тривалентним. Відомо, що валентні орбіталі є рівноцінними внаслідок процесу sp2 -гібридизації, які умовно зображають у вигляді несиметричних вісімок, розміщених у просторі під кутом 120°.

Хімічні зв’язки у молекулі BCl3 утворюються внаслідок перекривання sp2 -гібридних орбіталей атома Бору та 3 px -орбіталей атомів Хлору.
У молекулі СН4 зв’язки утворюються при перекриванні чотирьох гібридизованих орбіталей атома Карбону з s -орбіталями атомів Гідрогену. Такий тип гібридизації називають sp3- гібридизацією.
Скорочена електронна формула атома Карбону:
6C ...2s22p2,
розподіл електронів по квантових комірках:
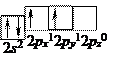
Валентність Карбону в такому стані рівна двом, але при збудженні атома відбувається розпаровування електронів згідно зі схеми:

і валентність його дорівнює чотирьом. На практиці встановлено, що всі чотири орбіталі є рівноцінними внаслідок їх гібридизації і утворення чотирьох нових sp3 -гібридних орбіталей:
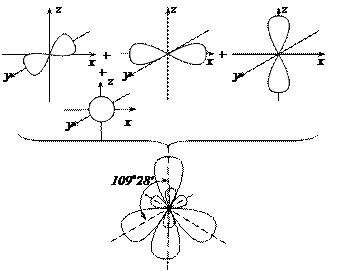
Хімічні зв’язки в CH4 утворюються внаслідок перекривання sp3 -гібридних орбіталей атома Карбону та s- орбіталей атомів Гідрогену:

Тверді речовини, як правило, мають кристалічну будову. Вона характеризується правильним розміщенням частинок у чітко визначених точках простору. При уявному з’єднанні цих точок прямими лініями, що перетинаються, утворюється просторовий каркас, який називають кристалічною граткою. Точки, в яких розміщені частинки, називаються вузлами кристалічної гратки. У вузлах гратки можуть розміщуватись йони, атоми або молекули. Залежно від виду частинок і характеру зв’язку між ними розрізняють чотири типи кристалічних граток: йонні, атомні, молекулярні й металічні.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1462; Нарушение авторских прав?; Мы поможем в написании вашей работы!