
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв’язку задач. Приклад 1. У 50 г розчину міститься 2,5 г калій гідроксиду KОН
|
|
|
|
Приклад 1. У 50 г розчину міститься 2,5 г калій гідроксиду KОН. Обчисліть масову частку KОН.
| Д а н о: m (KOН) = 2,5 г mр–ну = 50 г | Р о з в’ я з о к:
Використовуючи формулу для визначення масової частки

|
| В и з н а ч и т и: ω (KOН) –? | |
визначаємо масову частку KОН: 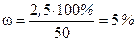
| |
| В і д п о в і д ь: ω (KOН) = 5 %. |
Приклад 2. Визначте молярну концентрацію розчину сульфатної кислоти, якщо в 100 мл цього розчину міститься 4,904 г H2SO4.
| Д а н о: Vр–ну = 100 мл = 0,1 л m (H2SO4) = 4,904 г | Р о з в’ я з о к: Мольна маса H2SO4 М (H2SO4) = 98 г/моль. За формулою ν = т / М визначимо кількість моль H2SO4: |
| В и з н а ч и т и: См –? | |
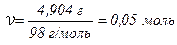 Знаходимо молярну концентрацію 100 мл (0,1 л) розчину сульфатної кислоти:
Знаходимо молярну концентрацію 100 мл (0,1 л) розчину сульфатної кислоти:

| |
| В і д п о в і д ь: См = 0,5 моль/дм3 |
Приклад 3. Обчисліть молярну концентрацію 15 %–го розчину сульфатної кислоти (ρ = 1,10 г/см3).
| Д а н о: ρ р–ну = 1,10 г/см3 ωр–ну = 15 % | Р о з в’ я з о к:
Молярну концентрацію розчину визначаємо за формулою: 
|
| В и з н а ч и т и: См (H2SO4) –? | |
Знаючи, що ν = тр.р./М, а 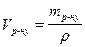 , підставимо їх у формулу для знаходження молярної концентрації , підставимо їх у формулу для знаходження молярної концентрації
 Молярна маса М(H2SO4) = 98 г/моль.
Виходячи з формули
Молярна маса М(H2SO4) = 98 г/моль.
Виходячи з формули 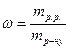 , приймемо, що маса розчину 100 г, тоді маса розчиненої речовини 15 г.
Підставивши значення у вищевиведену формулу, отримаємо: , приймемо, що маса розчину 100 г, тоді маса розчиненої речовини 15 г.
Підставивши значення у вищевиведену формулу, отримаємо:

| |
| Відповідь: См (H2SO4) = 1,6837 моль/дм3. |
Приклад 4. В якому співвідношенні за масою необхідно змішати 14 % - нийі 56 %-ний розчини сульфатної кислоти, щоб приготувати 20 %-ний розчин?
Р о з в’ я з о к: Користуючись правилом хреста, складемо схему:

Кожна різниця показує масові частки того розчину, масова частка якого написана на тій самій горизонтальній стрічці. Отже, для приготування 20%-го розчину необхідно взяти 6 масових частин 56 %-го і 36 масових частин 14 %-го розчину.
|
|
|
Відповідь: 6 мас. ч. 56 %-гоі 36 мас. ч. 14 %-го розчинів.
Приклад 5. Визначити рН 0,03 М розчину НСl.
Розв’язок: Сильні кислоти дисоціюють у водних розчинах повністю і концентрація йонів Гідрогену рівна концентрації кислоти:
НСl ↔ Н+ + Cl–
[НСl] = 0,03 М і, відповідно [Н+] = 0,03 М.
Звідки:
рН = – lg [Н+] = – lg 3∙10–2 = 2 – lg 3 = 1,5.
Відповідь: Для 0,03 М розчину НСlрН = 1,5.
Приклад 6. Визначити рН 0,01 М розчину NaOH.
Розв’язок: NaOH – сильна основа.
NaOH ↔ Na+ + OH–
[NaOH] = 0,01 М і, відповідно [OН–] = 0,01 М.
Отже, рОН = – lg [ОН–] = – lg 10–2 = 2
Враховуючи, що рН + рOH = 14, одержимо
рН = 14 – рОН = 14 – 2 = 12.
Відповідь: Для 0,01 М розчину NaOH рН = 12.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 593; Нарушение авторских прав?; Мы поможем в написании вашей работы!