
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Другий закон Рауля
|
|
|
|
Перший закон Рауля(1887)
Явище осмосу. Осмотичний тиск. Закон Вант-Гоффа.
Осмос -процес односторонньої дифузії крізь мембрану.
Дифузія - процес самовільного вирівнювання концентрації розчину 2 сторонній процес руху молекул речовин у воду і молекул води в концентрований розчин внаслідок теплового руху.
Врезультаті осмосу концентрація розсину зменшується його об’єм зростає а рівень чистої води знижується.По мірі зростання перепаду висот hзростає гідростатичний тиск розчину на мембрану під дією якого прискорюється дифузія молекул води в зворотньому напрямі (зворотній осмос). Тиск що виникає в розчині внаслідок осмосу називається осмотичним тиском.
Вант-Гофф звернув увагу на те що осмотичний тиск розведених розчинів неелектролітів підлягає законам ідеальних газів толі за рівнянням Менделєєва-Клапейрона
PV=m/M*RT
P=m/(M*V)*RT RT=CMRT
При сталій температурі осмотичний тиск розведених розчинів неелектролітів прямо пропорційний молярної концентрації розчиненої речовини.
30. Зниження тиску насиченої над розчинами.Замерзання і кипіння розчинів.Закон Рауля
Тиск пари над розчином яка перебуває в рівновазі з рідиною називать тиском насиченої пари даної речовини за даних умов.
Темпера кипіння – це температура при якій тиск пари= зовнішньому тиску.
При t<tкип випаровування відбувається тільки з поверхні рідини і його швидкість пропорційна площі цієї поверхні.Після розчинення в воді неелектроліту частина поверхні одержаного розчину буде зайнята частинками розчиненої речовини
Тому поверхня з якої відкриваються молекули розчинника зменшиться наслідком чого буде зменшення швидкості випаровування і зниження тиску насиченої пари розчинника.
|
|
|
Відносне зниження тиску насиченої пари розчинника над розведеним розчином неелектролітів= молярній частці розчиненої речовини
P0-P/P0=N
Наслідком зниження тиску пари розчинника над розчинами є підвищення tкип та зниження tзамерз розчинів порівняно з чистим розчинником.
Підвищення температури кипіння і зменшення температури замерзання розведених розчинів неелектролітів прямо пропорційні молярній концентрації розчиненої речовини
Δtкип=E*CM E-ЕБУЛІОСКОПІЧНА СТАЛА
Δtзам=K*Cm K-кріоскопічна стала.
Величина Е і К залежить тільки від природи розчинника.
31 Розчини електролітів. Теорія електролітичної дисоціації. Ступінь та константа дисоціації слабких електролітів. Ступінчаста дисоціація.
Електроліти - речовини, що дисоціюють на іони при розчиненні у полярних розчинниках
Електролітична дисоціація - процес розпаду речовини на іони при розчиненні
Ступінь дисоціації (a) - доля кількості речовини електроліту, що розпалася на іони
Електроліти – це речовини розчини чи розплави яких проводять електричний струм.
Електролітична дисоціація відбувається під дією полярних молекул розчинника – це складний фізико-хімічний процес.
" теорія електролітичної дисоціації ".
Після винаходу в 1800 р. гальванічно-го елемента італійцем А. Вольта вченірізних країн почали поглиблено вивчати хімічну дію електричного струму. Англійці В. Нікольсон і Н. Карлейль здійснили електроліз води, англієць Г. Деві у 1803 р. одержав лужні та лужно-земельні метали (К, Na, Ba,Са, амальгами) електролізом розплавлених лугів і солей.
У 1830 р. англієць М. Фарадей відкрив закони електролізу. Він увів терміни,які й зараз широко вживаються (катод і анод, електроліт і неелектроліт,йон, катіон і аніон, електрохімічнийеквівалент). Катодом він називав негативно заряджений електрод, анодом — позитивно заряджений електрод, електролітами — речовини, якs розкладаються електричним струмомна йони. Однак останнє визначен-ня було помилковим. Катіонами та аніонами він вважав йони, які розряджаються на катоді й аноді.Швед С. Арреніус у результаті експериментальних досліджень розробив теорію електролітичної дисоціації, за що йому в 1903 р. було присуджено Нобелівську премію. Він довів,що розклад речовин у розчині на йони відбувається й без дії електричного струму. У цей жчас Д. І. Менделєєв сформулював гідратну теорію розчинів, згідно з якою під час розчинення речовин відбувається сольватація — поєднання молекул розчиненої речовин з молекулами розчинника, унаслідок чого утворюють-ся сольвати (у водних розчинах — гідрати). На перший погляд, ці дві теорії здавалися протилежними,але в 1888–1891 рр. працями російських учених
|
|
|
І. Каблукова і В. Кистяковського вони були об’єднанів одну сучасну теорію електролітичної дисоціації.Отже, механізм електролітичної дисоціації — це єдність протилежних процесів: сольватації та йонізації, йонізації та асоціації. У процесі сольватації утворюються нові хімічні зв’язки. Під час йонізації хімічні зв’язки руйнуються.Сольватація є причиною йонізації, йонізація є наслідком сольватації.У розплавах йонних речовин причиною руйнування кристалічних ґраток та йонізації речовини є температура, відповідна для кожної речовини (температура плавлення).
Сполуки які здатні дисоціювати мають назву електроліти. До електролітів належать солі кислоти основи тобто сполуки які мають йонний зв'язок або ковалентно-полярний який легко перетворюється в цонний.
З точки зору класичної теорії електролітичної дисоціації усі електроліти характеризуються величиною яка має назву ступінь дисоціації.
α =nд/n n-загальна кількість молекул
nд-кількість молекул які продисоціювали
Класична теорія дисоціації дозволяє пояснити ефекти реакції нейтралізації реакцію гідролізу кислотні лужні властивості розчинів. Але класична теорія не враховує взаємодії між іонами та молекулами розчинника. При збільшенні концентрації іонів в розчині посилюється взаємодія між ними рухомість іонів ускладнюється і це прявляється у явному зниженні концентрації.
|
|
|
Константа дисоціації в хімії та біохімії — специфічний тип константи рівноваги, що описує схильність хімічного об'єкта оборотно розпадатися на компоненти, наприклад, дисоціації комплексу на окремі молекули в його складі або розпаду солі наіони. Константа дисоціації позначається  і є зворотною величиною до константи спорідненості. У випадку солей константа дисоціації може називатися константою іонізації. Це фізична величина, що характеризується відношенням добутку рівноважних концентрацій дисоційованих іонів до рівноважної концентрації недисоційованих молекул. Кd не виникає для сильних електролітів.
і є зворотною величиною до константи спорідненості. У випадку солей константа дисоціації може називатися константою іонізації. Це фізична величина, що характеризується відношенням добутку рівноважних концентрацій дисоційованих іонів до рівноважної концентрації недисоційованих молекул. Кd не виникає для сильних електролітів.
Для загальної реакції дисоціації:
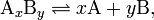
де комплекс 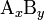 розпадається на x субодиниць A і y субодиниць B, константа дисоціації визначається як
розпадається на x субодиниць A і y субодиниць B, константа дисоціації визначається як

де [A], [B] і [AxBy] — концентрації A, B і комплексу AxBy, відповідно.
Константа дисоціації
Для порівняння сили слабких електролітів частіше, ніж ступінь дисоціації, використовують константу дисоціації, оскільки вона, на відміну від ступеня дисоціації, не залежить від концентрації електроліту.У водних розчинах слабкі електроліти дисоціюють частково. Між молекулами та йонами слабкого електроліту в розчині встановлюється хімічна рівновага.
Константа дисоціації електроліту - це фізична величина, що дорівнює відношенню добутку концентрацій йонів, на які дисоціював електроліт, до концентрації недисоційованих молекул електроліту. Цю константу називають ще константою йонізації.
Константа дисоціації електроліту залежить від температури, природи
електроліту та розчинника, але незалежить від їх концентрацій. Вона є кількісною характеристикою сполук. Чим більша константа дисоціації, тим сильніше дисоціює електроліт
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2087; Нарушение авторских прав?; Мы поможем в написании вашей работы!