
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фізичні властивості
|
|
|
|
Оксид карбону(IV), або вуглекислий газ, С02 за звичайних умов — безбарвний газ, без запаху, важчий за повітря в 1,5 раза, доволі добре розчиняється у воді, особливо під тиском, легко перетворюється на рідину навіть за кімнатної температури і невеликого тиску (5 МПа). Зріджений С02 зберігають у стальних балонах. Якщо його швидко вилити з балона, вуглекислий газ випаровується, внаслідок чого частина газу перетворюється на снігоподібну масу. Твердий вуглекислий газ називають сухим льодом.
Оксид карбону СО, або чадний газ, — безбарвний, без запаху, погано розчиняється у воді, важко перетворюється на рідину (за нормального тиску і температури -191,5 °С), трохи легший за повітря.
Обчисліть відносні молекулярні маси вуглекислого та чадного газів і порівняйте їх з усередненою відносною молекулярною масою повітря, яка дорівнює 29. Чи залежить густина газу від його молекулярної маси?
Вуглекислий газ С02 у великих кількостях шкідливий для людіни і тварин, спричинює запаморочення, може викликати ядуху, тому приміщення, де перебувають люди, треба часто провітрювати.
Чадний газ СО — дуже отруйний. Він утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає властивість переносити кисень в організмі, і настає кисневе голодування. У людини з'являються сильний головний біль, нудота, вона може знепритомніти і навіть померти!
Особливо небезпечно заводити автомобіль у гаражі за зачиненими дверима... Це рівнозначно самогубству! Заслінку в печі можна закривати тільки тоді, коли вугілля вже не горить полум'ям, а лише слабко жевріє...
Оксид силіцію(ІV) SiO2, або діоксид силіцію, — тверда речовина, кристалічна, безбарвна, тугоплавка (t пл. 1728 °С), у воді не розчиняється (пригадайте білий річковий пісок).
|
|
|
Чому ж така велика відмінність у властивостях діоксиду силіцію SiO2 і діоксиду карбону С02 (за звичайних умов С02 — газ, а Sі02 — тверда тугоплавка речовина), адже за хімічним складом ці оксиди є аналогами?
Щоб зрозуміти причину відмінності їхніх властивостей, пригадайте, що властивості речовини залежать від її будови. Отже, причина відмінності властивостей оксиду карбону (IV) і оксиду силіцію (IV) полягає у відмінності будови цих речовин. Оксид карбону (IV) складається з молекул С02, тобто має молекулярні кристалічні ґратки, а оксид силіцію (IV) — атомні кристалічні ґратки, кожна структурна одиниця яких являє собою тетраедр з атомом Силіцію в центрі та атомами Оксигену по кутах. Це можна пояснити тим, що атом Силіцію має більший радіус, ніж атом Карбону. Навколо нього може розміститись не два, а чотири атоми Оксигену, кожний з яких з'єднується з двома атомами Силіцію. Відповідне розміщення атомів можна зобразити на площині схемою:
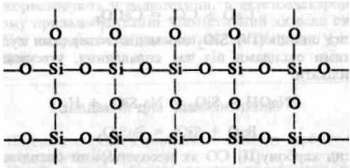
Така будова оксиду силіцію (IV) й обумовлює його високу твердість і тугоплавкість.
Отже, відмінністю у будові кристалічних ґраток пояснюється відмінність властивостей діоксидів карбону й силіцію.
Хімічні властивості
Оксид карбону (ІV) С02 і оксид силіцію (ІV) Sі02 — солетвірні кислотні оксиди, а оксид карбону (ІІ) СО — несолетвірний оксид.
1. Взаємодія з водою. Якщо у пробірку з водою (1 — 2 мл) додати 1—2 краплі розчину лакмусу, а потім пустити туди вуглекислий газ, лакмус змінить своє забарвлення, і розчин почервоніє. Це пояснюється тим, що С02 взаємодіє з водою з утворенням нестійкої карбонатної кислоти:
H2O + CO2 ⇔ H2CO3
Знаючи закономірності зміщення хімічної рівноваги, зазначте, в якому напрямі можна змістити рівновагу в реакції, рівняння якої наведено вище:
а) підвищуючи тиск; б) підвищуючи температуру.
|
|
|
Оксид силіцію (IV) SiO2 хоча й належить до кислотних оксидів, але з водою не реагує. Відповідна йому силікатна кислота H2Si03 утворюється іншим шляхом (вивчатиметься пізніше).
2. Взаємодія з основами і основними оксидами. Оксид карбону (IV) С02 реагує з лугами у водних розчинах та з твердими лугами і основними оксидами за звичайних умов, утворюючи солі — карбонати:
Са(ОН)2 + С02 - СаС03↓ + Н20
СаО + С02 = СаС03
Оксид силіцію (IV) Si02 взаємодіє з твердими лугами та основними оксидами під час сплавляння, утворюючи солі — силікати:
2NaOH + Si02 = Na2Si03 + Н20
BaO + Si02 = BaSi03
Оксид карбону(ІІ) CO як несолетвірний оксид зазначених вище реакцій не дає (солей не утворює). Йому притаманні інші властивості:
а) здатність горіти васильково-синім полум'ям, виділяючи велику кількість теплоти:
2СО + О = 2С02, Δ H = -572 кДж,
через що його використовують (разом з іншими газами) як газувате паливо (у доменному виробництві); б) здатність відновлювати метали з оксидів (під час нагрівання):
Fe304 + 4СО = 3Fe + 4С02↑
Зазначена властивість використовується під час виплавляння металів із руд.
Добування оксиду карбону(ІУ). У лабораторних умовах С02 добувають дією хлоридної кислоти на мармур:
СаС03 + 2НСl = СаСl2 + Н20 + С02↑
Запишіть рівняння даної реакції у повній і скороченій йонних формах.
У промисловості оксид карбону(ІV) добувають прожарюванням вапняку:
СаС03 = СаО + С02↑
Застосування. Вуглекислий газ С02 застосовують під час виробництва соди, цукру, для газування води, гасіння пожеж (наприклад, содові вогнегасники). Сухий лід використовують для зберігання продуктів, які швидко псуються.
Діоксид силіцію SiO2 у вигляді піску широко застосовують у будівництві, для добування скла, кераміки, порцеляни, фаянсу, цегли, цементу, абразивів1. У вигляді кварцу Sі02 використовують у радіотехніці, в акустоелектроніці, в оптичному приладобудуванні. Синтетичний діоксид силіцію Sі02 («біла сажа») застосовується як наповнювач у виробництві гуми.
Абразиви (фр. abrasif — шліфувальний, від лат. abrado — зіскоблюю) — природні або штучні матеріали високої твердості.
Сульфатна кислота H2S04 (безводна, 100%-ва) — важка безбарвна оліїста рідина. Густина її концентрованого розчину (w(H2S04) = 98%) за звичайних умов 1,84 г/см3. Вона нелетка, запаху не має. Надзвичайно гігроскопічна. Активно вбирає вологу. Змішується з водою у будь-яких співвідношеннях. Розчинення сульфатної кислоти у воді супроводжується виділенням великої кількості теплоти, що може призвести до закипання води і розбризкування кислоти.
|
|
|
Сульфатна кислота — їдка рідина, тому треба остерігатись, щоб вона не потрапила на шкіру й одяг. А якщо це сталося, треба швидко змити її великою кількістю води, після чого нейтралізувати розчином соди і знову змити водою. Пам'ятайте таке правило:
Не можна воду доливати до концентрованої сульфатної кислоти! Для розбавляння кислоту треба доливати до води невеликими порціями.
Хімічні властивості сульфатної кислоти багато в чому залежать від її концентрації. В лабораторіях та промисловості використовують розбавлену і концентровану сульфатну кислоту, хоча такий поділ дещо умовний.
Розбавлена сульфатна кислота виявляє всі хімічні властивості, характерні для кислот.
1. Дисоціація кислоти. Сульфатна кислота двохосновна, належить до сильних кислот. У водних розчинах вона дисоціює на йони за двома ступенями (за першим — практично повністю):
I ступінь Н2S04 ⇔ Н++ НSО-4 — гідросульфат-іон
II ступінь НS0-4 ⇔ Н+ + S02-4 — сульфат-іон
Ось чому в процесі нейтралізації розчинів сульфатної кислоти Н2S04 утворюються два ряди солей: середні солі — сульфати і кислі солі — гідросульфати.
2. Взаємодія з основами. Якщо у пробірку з розбавленою сульфатною кислотою добавити дві-три краплі фіолетового лакмусу, розчин набуває червоного забарвлення (кисле середовище). Потім у цю пробірку доливатимемо краплями розчин гідроксиду натрію доти, доки вміст пробірки набуде фіолетового забарвлення (нейтральне середовище):
2NaОН + Н2S04 = Nа2SО4 + 2Н20
сульфат натрію
Якщо ж розчину лугу Na0Н не вистачає для нейтралізації усієї кислоти, то сіль, що утворюється, буде кислою:
Na0H + Н2S04 = NаНS04 + Н20
гідросульфат натрію
Отже, гідросульфати утворюються тоді, коли кислота береться у надлишку.
Більшість сульфатів добре розчиняються у воді. Малорозчинним є сульфат кальцію CaS04, ще менше розчиняється сульфат плюмбуму PbS04 і практично нерозчинній є сульфат барію BaS04 (див. таблицю розчинності).
|
|
|
3. Взаємодія з оксидами металів. Сульфатна кислота реагує з основними та амфотерними оксидами, утворюючі солі, наприклад:
MgO + H2S04 = MgS04 + Н20
ZnO + H2S04 = ZnS04 + H20
4. Взаємодія з солями. Сульфатна кислота сильна і нелетка, одна з найстійкіших із відомих мінеральних кислот. Вона може вступати в реакцію обміну з солями, утвореними слабкішими або леткими кислотами і навіть сильними кислотами, якщо вони менш стійкі:
Na2C03 + H2S04 = Na2S04 + С02↑ + H20
2KN03 + H2S04 = K2S04 + 2HN03↑
2KCl04 + H2S04 = K2S04 + 2HCl04
BaCl2 + H2S04 = BaS04↓+ 2НСl↑
Останнє рівняння відображує якісну реакцію на кислоту та її солі, бо утворюється нерозчинний у воді сульфат барію BaS04.
Сульфатна кислота може взаємодіяти із своїми солями — сульфатами. При цьому середні солі — сульфати перетворюються на кислі солі гідросульфати:
Na2SO4 + H2S04 = 2NaHS04
Усі реакції, рівняння яких наведені у пункті 4, є реакціями йонного обміну. Напишіть їх у повній і скороченій йонних формах.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1164; Нарушение авторских прав?; Мы поможем в написании вашей работы!