
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фізичні властивості металів
Пластичність. Механічна дія на кристал із металічним зв’язком викликає зсув шарів атомів, але завдяки переміщенню валентних електронів по всьому зразку металу розриву зв’язків не відбувається. Найпластичніший метал — золото. Марганець і бісмут — крихкі метали.
Металічний блиск, непрозорість. Вільні електрони взаємодіють із квантами світла, які падають на метал.
Електрична провідність. Вільні електрони під впливом різниці потенціалів набувають направленого руху від негативного полюса до позитивного. Найбільшу електричну провідність мають срібло і мідь.
Теплопровідність. Зумовлена рухом вільних електронів. Найбільша теплопровідність у срібла й міді, найменша — у бісмуту та ртуті.
Густина, температури плавлення 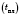 і кипіння
і кипіння  , твердість металів різні. Метали з густиною, меншою за 5 г/см3, називаються легкими, інші — важким и. Метали з температурою плавлення понад 1000 °С називаються тугоплавкими, нижче — легкоплавким и.
, твердість металів різні. Метали з густиною, меншою за 5 г/см3, називаються легкими, інші — важким и. Метали з температурою плавлення понад 1000 °С називаються тугоплавкими, нижче — легкоплавким и.
Метал є одним з найнеобхідніших матеріалів в промисловості, будівництві, сільському господарстві та інших видах життєдіяльності людини. Незважаючи на те, що сьогодні все більш популярним матеріалом стає пластик, труби з нього можуть використовуватися тільки в приміщеннях, а конструкції, що проходять під землею, можна виготовляти тільки з металу.
Найчастіше в промисловості та будівництві використовуються не чисті метали, а їх сплави, в основі яких лежить небудь елемент і різноманітні добавки, що поліпшують його якості – надійність, міцність і т.д. Найпоширенішими сплавами є сталь, чавун, а також матеріали, в основі яких лежить мідь і алюміній.
Сталь є найбільш затребуваним металом. Подібний висновок можна зробити, проаналізувавши щорічні обсяги виробництва того або іншого металу. У більшості випадків, сталь являє собою сплав заліза з вуглецем, кількість якого сягає двох відсотків. Сплави сталі підрозділяються на кілька видів: маловуглецевої, рівень вуглецю в яких не перевищує 0,25%, високовуглецеві з вмістом вуглецю понад 0,55% і леговані, доповнені нікелем, хромом, ванадієм. Для того щоб значення стали в житті людини стало для вас більш явним, спробуйте пригадати всі металеві предмети, які ви використовували протягом дня, – ножі, бритву і т.д. всі вони виготовлені зі сталі.
На другому місці за обсягом виробництва знаходиться чавун, який також являє собою сплав заліза і вуглецю. Тільки на відміну від сталі, кількість останнього в чавуні дещо більше. Для додання сплаву міцності в чавун додається кремній. Особливо широке поширення чавун отримав в будівництві: він використовується для виготовлення трубопровідної арматури, кришок люків і інших елементів, основною вимогою яких є міцність. Крім цього, з чавуну виробляється і деяка посуд: так, в радянський час у кожної господині на кухні була сковорода з чавуну.
Хоча сплави з алюмінію не так поширені, як матеріали, названі вище, деякі їхні переваги роблять їх незамінними для деяких операцій. Перш за все, сплави з алюмінію відрізняє економічність, легкість в обробці й іншому використанні, а також легкодоступність. Такі сплави без праці піддаються куванню, зварці, штампуванню і іншим подібним операціям, а також добре піддаються обробці на металорізальних верстатах. Використання алюмінієвих сплавів обмежено лише тим, що при високих температурах вони втрачають ряд своїх властивостей. Так, температура двісті градусів за Цельсієм уже є для них високою, між тим, як термостійкість – це дуже важлива властивість металу. До достоїнств алюмінієвих сплавів відноситься їх нешкідливість і екологічність, завдяки чому їх можна використовувати навіть для зберігання і перевезення харчових продуктів, стійкість до появи корозії, висока відбивна здатність, а також немагнитность. Найбільш часто алюмінієві сплави застосовуються в харчовій промисловості та машинобудуванні. Крім цього, вони необхідні для створення високовольтних ліній і виготовлення деяких архітектурно-оздоблювальних матеріалів.
Більшість крупних машинобудівних та інших промислових підприємств, а також будівельних фірм не працює безпосередньо з металом, купує необхідний для їх виробництва металопрокат, виготовлений металургійними заводами, згідно ГОСТам або за індивідуальними кресленнями замовника.
У результаті взаємодії металів із зовнішнім середовищем їх поверхня вкривається тонким шаром (плівкою) різних хімічних сполук (продуктів корозії): оксидів, хлоридів, сульфідів і т. д. Інколи цей шар такий щільний, що крізь нього не може проникати агресивне середовище. В таких випадках з часом швидкість корозії зменшується, а то й зовсім припиняється. Наприклад, алюміній в атмосфері повітря кородує значно повільніше від заліза, хоч за своїми хімічними властивостями він активніший від заліза. Це пояснюється тим, що поверхня алюмінію вкривається суцільною, досить щільною і міцною оксидною плівкою, яка ізолює метал від доступу кисню, а оксидна плівка заліза, навпаки, є крихкою і ламкою, містить багато пор і тріщин, через що кисень повітря крізь неї легко проникає до поверхні заліза, і тим обумовлюється безперервне його руйнування. Одним з найпоширеніших способів боротьби з корозією є покриття металу (головним чином заліза) масляними фарбами. Захисна дія фарби основується на тому, що оліфа, піддаючисьполімеризації, утворює на поверхні металу суцільну еластичну плівку, яка ізолює метал від дії атмосферних хімічних агентів. Інколи для захисту металу від корозії (наприклад, алюмінію і деяких стальних виробів) штучно створюють оксидну плівку обробкою їх поверхні сильними окисниками.


Схема корозії оцинкованого заліза
Значного поширення одержав також спосіб покриття одного металу іншим. Наприклад, дахове залізо покривають тонким шаром цинку. З цією метою залізні листи занурюють на короткий час у розплавлений цинк. Сам по собі цинк в атмосфері повітря не піддається корозії, оскільки на його поверхні утворюється досить стійка захисна оксидна плівка ZnO. При пошкодженні цинкового шару (тріщини, подряпини тощо) цинк з залізом у присутності вологи повітря утворює гальванічну пару. При цьому електрохімічному корозійному руйнуванню піддається цинк як активніший метал, а залізо не руйнується доти, поки не буде зруйнований весь захисний шар цинку. Конкуренцію традиційному цинкуванню складає покриття сталевих листів алюцинком.
На цьому ж принципі основується і так званий протекторний спосіб захисту металів від корозії. Суть цього способу полягає в тому, що металеву конструкцію сполучають металічним провідником з активнішим металом, який піддається корозійному руйнуванню. Наприклад, у парові котли інколи вводять листи цинку, які сполучають залізними стержнями з стінками котла. При цьому утворюється в середовищі води гальванічна пара, внаслідок чого цинк, як активніший метал руйнується, а залізні стінки котла не піддаються корозії. Так само можна захищати і підземні трубопроводи.
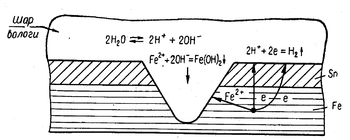

Схема корозії луженого заліза
Інколи металеві вироби вкривають захисним шаром менш активного металу. Прикладом цього може служити біла жерсть, з якої виробляють консервні банки. Її одержують зануренням на короткий час залізних листів у розплавлене олово. Оловодуже добре захищає залізо доти, поки його шар суцільний. Але коли захисний шар пошкоджується і залізо приходить у дотик з агресивним середовищем, воно з оловом утворює гальванічну пару і залізо як активніший метал піддається корозійному руйнуванню. При цьому залізо кородує значно скоріше, ніж у тому випадку, коли воно не вкрите шаром олова.
Досить поширеним є гальванічний спосіб покриття одного металу іншим (шляхом електролізу). Цим способом покривають нікелем (нікелювання), хромом (хромування), міддю (міднення), сріблом (сріблення), золотом (золочення) і іншими металами. Гальванічним способом можна наносити дуже тонкий і рівномірний шар захищаючого металу. Гальванічні покриття не тільки захищають металічні вироби від корозії, а й надають їм гарного зовнішнього вигляду.
Для боротьби з корозією в середовищі рідин застосовують спеціальні добавки, так звані інгібітори, тобто сповільнювачі корозії. Інгібіторами можуть бути різні речовини: хромат натрію, дихромат калію, фосфат натрію тощо, а також желатин, клей та інші органічні речовини. Інгібітори сприяють утворенню на кородуючій поверхні металу міцної захисної плівки, внаслідок чого швидкість корозії може зменшуватись у десятки і сотні разів. Особливо важливу роль відіграють інгібітори при взаємодії металів з кислотами. Так, наприклад, коли додати деякі інгібітори до хлоридної кислоти, то її можна зберігати в стальній тарі, хоч хлоридна кислота з залізом взагалі реагує досить енергійно. Крім того, останнім часом стали широко застосовувати сплави з високими антикорозійними властивостями. Такі сплави одержують шляхом добавок до основного металу інших металів — нікелю, кобальту, хрому і ін. Прикладом антикорозійних сплавів може служити сталь із вмістом 15—20% Зі. Така сталь цілком стійка до дії кислот. З неї виготовляють різну хімічну апаратуру.
Лу́жні мета́ли — елементи групи 1 періодичної системи, за старою класифікацією головної підгрупи I групи. Назва пов'язана з тим, що при взаємодії лужних металів з водою утворюється їдкий луг. До лужних металів належать (у порядку збільшення атомного номера) літій (Li), натрій (Na), калій (K), рубідій (Rb), цезій (Cs),францій (Fr).
Фізичні властивості [ред.]
Лужні метали — м'які (натрій ріжеться ножем, як вершкове масло, інші трохи жорсткіші) метали від сріблясто-білого до сірого кольору з характерним блиском, які дуже швидко тьмяніють на повітрі. Легкоплавкі й рухливі. Агресивні, вибухонебезпечні (зберігаються в атмосфері інертного газу або під шаром гасу)
Хімічні властивості [ред.]
1. Легко реагують із киснем. Літій при взаємодії з киснем утворює оксид Li2O, решта — пероксиди й супероксиди:
4Li + O2 = 2Li2O
4Na + O2 = 2Na2O
4K + O2 = 2K2O
2. Реагують із водою:
2Na + 2H2O = 2NaOH + H2
3. Реагують із неметалами:
2Na + S = Na2S
2K + Br2 = 2KBr
Всі кисневі сполуки мають різне забарвлення, інтенсивність котрого посилюється в ряді від Li до Cs:
Лу́жноземе́льні мета́ли — елементи головної підгрупи другої групи періодичної системи. До них відносяться хімічні елементи: берилій, магній, кальцій, стронцій, барій та радій[1]. За класифікацією IUPAC вони належать до групи 2 елементів[2]. Свою назву дана група металів отримала через їхні оксиди — «землі» (за термінологією алхіміків), які дають у воді лужну реакцію. Солі цих металів широко поширені у природі, найчастіше трапляються у якості мінералів.
Колір лужноземельних металів — світло-сірий або сріблястий. Хімічна активність зростає від кальцію до радію. За звичайних умов взаємодіють з О2 (берилій — при 500 °C), водою, F2, при 300–400 °С — з Н2 (крім берилію) і галогенами.
|
|
Дата добавления: 2015-05-24; Просмотров: 1776; Нарушение авторских прав?; Мы поможем в написании вашей работы!