
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Умови завдання
|
|
|
|
1. При згорянні 5,00 г металу утворюється 9,44 г оксиду металу. Визначте еквівалентну масу металу.
2. Одна й таж кількість металу реагує з 0,2 г оксигену і з 3,17 г одного з галогенів. Визначте еквівалентну масу галогену.
3. Для нейтралізації 5 г гідроксиду металу необхідно 6,13 г однієї кислоти або 7,877 г другої кислоти, еквівалент якої рівний 63,015. Розрахуйте еквівалентні маси гідроксиду металу і першої кислоти.
4. В одному оксиді нітрогену міститься 36,35 %, а в другому – 69,55 %. Розрахуйте еквівалентні маси нітрогену в кожному з оксидів.
5. Визначте еквівалентні маси металу і сульфуру, якщо 3,24 г металу утворюють 3,48 г оксиду і 3,72 г сульфіду.
6. При відновленні гідрогеном 20,342 г оксиду металу утворилось 6,504 г води. Еквівалентна маса води рівна 9,008 г/моль. Чому рівні еквівалентні маси металу і його оксиду?
7. Розрахуйте атомну масу двовалентного металу і визначте, який це елемент, якщо 8,34 г металу реагують з 0,68 л кисню (н.у.).
8. На відновлення 56,08 г оксиду металу затрачається 22,4 л водню (н.у.). Розрахуйте еквівалентні маси металу і його оксиду.
9. При взаємодії з кислотою 5,01 г металу виділяється 2800 мл водню (н.у.). Визначте еквівалент металу і його атомну масу, якщо валентність металу становить 2.
10. В оксиді металу міститься 39,69 % оксигену. Обчисліть еквівалентні маси металу і його оксиду.
11. 1,0 г деякого металу реагує з 8,89 г брому і з 1,78 г сірки. Знайти еквівалентні маси брому і металу, знаючи, що еквівалентна маса сульфуру рівна 16,0 г/моль.
12. Еквівалентна маса хлору рівна 35,5 г/моль, мольна маса атомів купруму рівна 63,5 г/моль. Еквівалентна маса купрум хлориду рівна 99,5 г/моль. Яка формула купрум хлориду?
13. Розрахуйте процентний вміст оксигену в оксиді металу, знаючи, що еквівалентна маса металу становить 8,9938 г/моль. Який це метал, якщо валентність його рівна 3?
|
|
|
14. Деяка кількість металу, еквівалентна маса якого рівна 27,9 г/моль, витісняє з кислоти 700 мл водню (н.у.). Визначте масу металу.
15. 1,06 г кальцію і 2,16 г цинку витісняють з кислоти однакові кількості водню. Розрахуйте еквівалентну масу цинку, знаючи, що еквівалентна маса кальцію рівна 20,0 г/моль.
16. На нейтралізацію 2,45 г кислоти витрачається 2,00 г натрій гідроксиду. Визначте еквівалентну масу кислоти.
17. Визначте еквівалентну і атомну маси елемента, знаючи, що в його оксиді на один атом елемента припадає три атоми оксигену, а вміст оксигену в оксиді становить 60 %.
18. Еквівалентна маса двовалентного металу рівна 20,04 г/моль. Розрахуйте еквівалентну масу його оксиду, процентний вміст оксигену в оксиді, атомну масу металу.
19. На повне згоряння 0,15 г деякого неметалу витрачається 280 мл кисню (н.у.). Розрахуйте еквівалентну масу неметалу.
20. Процентний вміст оксигену в оксиді тривалентного елемента становить 31,53 %. Розрахуйте еквівалентну і атомну масу елемента.
21. На відновлення 7,95 г оксиду металу витрачається 0,6 г карбону або 2,24 л водню (н.у.). Визначте еквівалентні маси металу, оксиду металу, карбону.
22. Еквівалентна маса тривалентного металу рівна 17,332 г/моль. Розрахуйте мольну масу оксиду цього металу.
23. При спалюванні 3 г сульфуру утворилося 6 г її оксиду. Чому рівна еквівалентна маса сульфуру?
24. Оксид ртуті містить 92,6 % металу. Визначте еквівалентну масу ртуті і її валентність у сполуці.
25. Скільки літрів водню при (н.у.) виділиться при розчиненні в хлоридній кислоті 18 г металу, еквівалентна маса якого рівна 9 г/моль?
26. Знайдіть атомну масу тривалентного елемента, знаючи, що з 1,5 г цього елемента утворюється 3,63 г хлориду. Еквівалентна маса хлору рівна 35,54 г/моль.
27. При взаємодії 5,95 г деякої речовини з 2,75 г хлороводню одержано 4,40 г солі. Розрахуйте еквівалентні маси речовини і утвореної солі.
|
|
|
28. 1 г чотиривалентного металу реагує з 0,27 г кисню. Розрахуйте атомну масу металу.
29. Враховуючи, що атомна маса ауруму рівна 197 г/моль, розрахуйте валентність цього елемента в сполуці складу – 64,9 % Au і 35,1 % Cl. Еквівалентна маса хлору рівна 35,54 г/моль.
30. При розкладі арґентум оксиду утворилося 2,158 г металу і виділилося 0,16 г кисню. Розрахуйте еквівалентну масу арґентуму.
31. Під яким тиском повинен знаходитися газ, щоб 1 моль його при 30 оС зайняв об’єм 20 л?
32. Який об’єм в літрах займає 400 г кисню при 27 оС і тиску 1,2 атм?
33. Стальний балон ємністю 20 л наповнено киснем при температурі 17оС і тиску 120 атм. Розрахуйте масу кисню.
34. Маса 1 л деякого газу при 27 оС і тиску 1,2 атм рівна 0,96 г. Розрахуйте мольну масу газу.
35. Під яким тиском знаходиться вуглекислий газ, якщо при 0 оС 1 л його важить 1,473 г?
36. При 17 оС деяка кількість газу займає об’єм 580 мл. Який об’єм займе ця ж кількість газу при 100 оС, якщо тиск його залишиться незмінним?
37. При 7 оС тиск газу в закритій посудині рівний 96 кПа. Яким стане тиск, якщо охолодити посудину до - 33 оС?
38. 36,95 г деякої речовини в газоподібному стані при 127 оС і при 720 мм рт.ст. займають об’єм 16,4 л. Розрахуйте молярну масу речовини.
39. Маса 380 мл газу при 27 оС і тиску 800 мм рт.ст. рівна 0,455 г. Розрахуйте молярну масу газу.
40. Який об’єм при н.у. займуть 1 г NH3 і 1 г N2?
41. Яка маса в грамах 1 молекули сульфур (IV) оксиду?
42. Скільки молекул містить 1 мл водню?
43. Який об’єм при н.у. займають 3,01.1022 молекул газу?
44. Які об’єми при н.у. займуть 1 г H2, 1 г Cl2, 1 г амоніаку?
45. Скільки молів міститься в 1 м3 будь-якого газу при н.у.?
46. Який об’єм займуть 70 г нітрогену при 21 оС і тиску 1065 мм рт.ст.?
47. При тиску 750 мм рт.ст. об’єм газу рівний 90 мл. При якому тиску його об’єм досягне 135 мл, якщо температура залишиться постійною?
48. При 3 оС і 730 мм рт.ст. об’єм газу рівний 1,2 л. Який об’єм займе цей газ при 0 оС і 760 мм рт.ст.?
49. Маса 2,24 л газу (н.у.) рівна 2,8 г. Яка молярна маса газу?
50. Яка молярна маса газу, якщо маса 600 мл його при н.у. рівна 1,714 г?
51. Знайти формулу речовини, що містить (за масою) 43,4 % натрію, 11,3 % карбону і 45,3 % оксигену?
52. Знайти формулу ванадій оксиду, якщо 2,73 г його оксиду містить 1,53 г металу.
|
|
|
53. Речовина містить (за масою) 26,53 % калію, 35,37 % хрому і 38,10 % оксигену. Встановити формулу речовини.
54. Встановити формулу кристалогідрату барій хлориду, якщо 36,6 г його при прожарюванні втрачають в масі на 5,4 г.
55. Встановити формулу речовини, що містить 54,5% карбону, 36,4% оксигену і 9,1% гідрогену, знаючи, що густина її пари за воднем становить 44.
56. При повному згорянні наважки органічної бромвмісної речовини масою 1,88 г одержано 0,88 г вуглекислого газу і 0,3 г води. Після перетворення всього брому, що містився в наважці, в бромід, одержано 3,76 г арґентум броміду. Густина пари речовини за воднем становить 94. Встановити формулу вихідної органічної речовини.
57. Розрахувати процентний вміст (за масою) кожного з елементів в сполуках: а) магній гідроксид; б) ферум (ІІІ) нітрат; в) сульфатна кислота; г) амоній сульфат.
58. Визначте молярну масу і формулу речовини, що містить 30,43 % нітрогену і 69,87 % оксигену, якщо густина за воднем цієї сполуки рівна 46.
59. Встановити формулу хром оксиду, що містить 68,4 % хрому за масою.
60. Яка маса в грамах 1 молекули води?
Запишіть електронні формули елементів з порядковими номерами (номери елементів вказані в задачах 61-90). Дайте характеристику квантових чисел, які при цьому реалізуються, розподіліть електрони останнього і передостаннього енергетичного рівня на орбіталях згідно з правилом Гунда.
61. Елементи: 21, 35, 37, 73, 58.
62. Елементи: 12, 20, 48, 53, 69.
63. Елементи: 25, 41, 61, 78, 11.
64. Елементи: 10, 32, 47, 53, 69.
65. Елементи: 9, 31, 46, 52, 68.
66. Елементи: 8, 30, 45, 51, 67.
67. Елементи: 7, 29, 44, 50, 68.
68. Елементи: 5, 27, 40, 59, 74.
69. Елементи: 6, 19, 35, 79, 61.
70. Елементи: 3, 17, 24, 53, 62.
71. Елементи: 8, 13, 37, 78, 58.
72. Елементи: 14, 32, 29, 82, 101.
73. Елементи: 15, 19, 27, 56, 90.
74. Елементи: 11, 17, 21, 30, 91.
75. Елементи: 20, 16, 29, 82, 92.
76. Елементи: 3, 14, 30, 55, 60.
77. Елементи: 19, 35, 79, 53, 66.
78. Елементи: 4, 9, 24, 50, 65.
79. Елементи: 11, 13, 26, 53, 71.
80. Елементи: 20, 14, 22, 30, 100.
81. Елементи: 22, 33, 37, 51, 90.
82. Елементи: 19, 35, 74, 55, 62.
83. Елементи: 20, 30, 40, 56, 65.
84. Елементи: 12, 17, 55, 78, 66.
85. Елементи: 4, 8, 24, 53, 92.
86. Елементи: 6, 12, 18, 23, 64.
87. Елементи: 3, 18, 30, 53, 90.
88. Елементи: 20, 35, 14, 80, 98.
89. Елементи: 21, 33, 37, 54, 62.
|
|
|
90. Елементи: 12, 16, 74, 65, 32.
В задачах 91 – 120 закінчити схеми ядерних перетворень.
91. а) 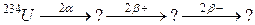
б) 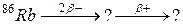
92. а) 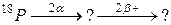
б) 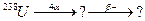
93. а) 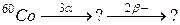
б) 
94. а) 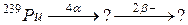
б) 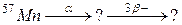
95. а) 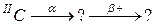
б) 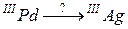
96. а) 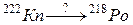
б) 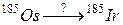
97. а) 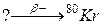
б) 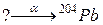
98. а) 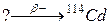
б) 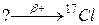
99. а) 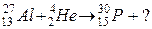
б) 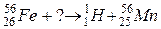
100. а) 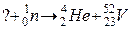

б) 
101. а) 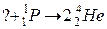
б) 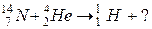
102. а) 
б) 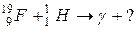
103. а) 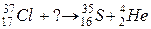
б) 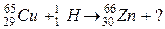
104. а) 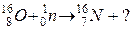
б) 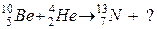
105. а) 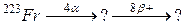
б) 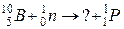
106. а) 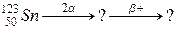
б) 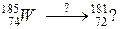
107. а) 
б) 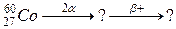
108. а) 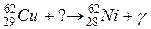
б) 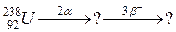
109. а) 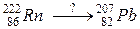
б) 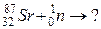
110. а) 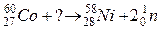
б) 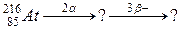
111. а) 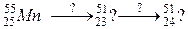
б) 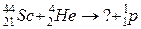
112. а) 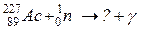
б) 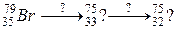
113. а) 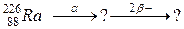
б) 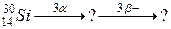
114. а) 
б) 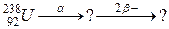
115. а) 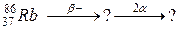
б) 
116. а) 
б) 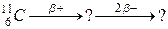
117. а) 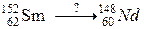
б) 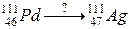
118. а) 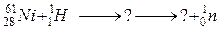
б) 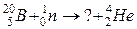
119. а) 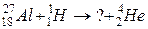
б) 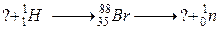
120. а) 
б) 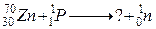
121. Який тип зв’язку між атомами в молекулах KCl, Na2S, Br2, H2O, NH3, HCl? Дайте визначення кожного типу зв’язку.
122. Що розуміють під поняттям “водневий зв’язок”? Наведіть приклади речовин, в яких реалізується водневий зв’язок.
123. Що таке полярні і неполярні молекули? Яким параметром характеризується полярність хімічного зв’язку? Наведіть приклади полярних молекул.
124. Поясніть, чому максимальна валентність фосфору може бути рівна п’яти, а для нітрогену такий валентний стан не реалізується.
125. Який тип хімічного зв’язку називають ковалентним? Як метод валентних зв’язків пояснює будову молекули води?
126. Які хімічні зв’язки і за якими механізмами реалізуються в іонах 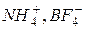 ?
?
127. Яку геометричну будову мають молекули 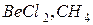 ? В якому гібридному стані знаходяться, відповідно, атоми Be і С?
? В якому гібридному стані знаходяться, відповідно, атоми Be і С?
128. На прикладі будови молекули азоту охарактеризуйте природу s- і p-зв’язку.
129. Охарактеризуйте типи зв’язків у натрій хлориді і калій сульфаті.
130. Розмістіть в порядку зростання ступеня йонності зв’язки B-Cl, Na-Cl, Be-Cl.
131. Вкажіть типи хімічного зв’язку в молекулах H2, Cl2, HCl. Наведіть схеми перекривання електронних хмар.
132. Як змінюється міцність зв’язку в ряді: HF – HCl – HBr – HJ?
133. Чи однакова геометрична конфігурація молекул BF3 і NF3?
134. В якій із молекул BF3 чи NF3 значення дипольного моменту більше?
135. Вкажіть типи гібридизації атомних орбіталей карбону в молекулі CO2.
136. Які типи гібридизації реалізуються для орбіталей атома сульфуру в молекулах SO2 і SO3?
137. Який тип зв’язку називають йонним? Згідно з яким механізмом він реалізується?
138. Що розуміють під виразом “ sp3 -гібридизація атомних орбіталей”? Наведіть приклади сполук, в яких реалізується цей тип гібридизації.
139. Як розміщені хмари при sp2 -гібридизації? Наведіть приклади сполук, в яких реалізується цей тип гібридизації. Яка геометрична конфігурація молекул цих речовин?
140. Який тип гібридизації має місце при утворенні молекул NH3 і H2O?
141. Які кристалічні структури називають іонними, атомними, молекулярними і металічними? Кристали яких з наведених речовин мають вказані структури: алмаз, хлорид натрію, карбон (ІV) оксид, цинк?
142. Які сили міжмолекулярної взаємодії називаються орієнтаційними, індукційними і дисперсійними? Охарактеризуйте природу цих сил.
143. Виходячи з уявлень про природу іонного зв’язку, поясніть, чому за звичайних умов йонні сполуки існують у вигляді йонних кристалів, а не у вигляді окремих молекул.
144. K2CO3 плавиться при890 оСбез розкладу, а Ag2CO3 розкладається вже при температурі 220 оС. Поясніть цю відмінність, виходячи з будови електронних рівнів цих металів.
145. BaCl2 у водних розчинах дисоціює повністю, а HgCl2 майже не дисоціює. Поясніть цю відмінність, виходячи з будови електронних рівнів цих металів.
146. Поясніть нестійкість купрум (І) і арґентум (І) гідроксидів.
147. Чому натрій хлорид при кімнатній температурі не утворює молекулярної структури?
148. Поясніть, виходячи з позицій методу ВЗ, здатність оксидів NO і NO2 утворювати димерні молекули.
149. Електронегативності гідрогену, оксигену і арсену відповідно рівні: 2,1; 3,5; 2,1. Розрахуйте різницю відносних електронегативностей атомів для зв’язків H-O і O-As. Який із цих зв’язків більш полярний? До якого виду гідроксидів належить As(OH)3?
150. Електронегативності калію, кальцію, алюмінію, германію і хлору відповідно рівні: 0,91; 1,04; 1,6; 2,0; 3,0. Розрахуйте різницю відносних електронегативностей атомів для зв’язків K-Cl, Ca-Cl, Al-Cl і Ge-Cl. Який зв’язок характеризується найбільшим ступенем йонності?
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2258; Нарушение авторских прав?; Мы поможем в написании вашей работы!