
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
РОЗЧИНИ 6 страница
|
|
|
|
в) HCl г) аскорбінову кислоту.
4.17. При анеміях як внутрішній засіб використовують 8,3 %-ий розчин HCl (ρ=1,04г/см3) На один прийом беруть 0,75 мл цього розчину і розводять водою до 50 мл. Розрахувати:
1) Яка маса чистої HCl в отриманому розчині:
а) 0,130; б) 0,090; в) 0,065; г) 0,150.
2) Яка масова концентрація одержаного розчину кислоти (ρ=1 г/см3):
а) 0,122%; б) 0,15%; в) 0,22%; г) 0,35%.
3) Яка молярна концентрація одержаного розчину кислоти:
а) 0,0212; б) 0,0335; в) 0,0258; г) 0,0035.
4) Чому дорівнює молярна маса еквівалента хлоридної кислоти у реакції з кальцій гідроксидом:
а) 36,5 г/моль; б) 18,25 г/моль;
в) 36 г; г) 73 г/моль.
5) Розчин AgNO3 є якісним реагентом на:
а) Cl; б) Ba; в) SO42-; г) Fe3+.
4.18. Необхідно приготувати ізотонічний розчин із наявних в лабораторії речовин.
1) Виберіть, яка із речовин може бути використана для виготовлення ізотонічного розчину:
а) калію хлорид; б) глюкоза;
в) магнію сульфат; д) етанол.
2) Виберіть формулу для розрахунку концентрації ізотонічного розчину.
а) 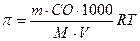 ; б) π=іСR;
; б) π=іСR;
в) π=СRT г) 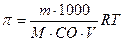
3) Осмотичний тиск крові людини в нормі:
а) 800кПа; б) 730 кПа;
в) 790 кПа; г) 750 кПа.
4) Розрахуйте молярну концентрацію ізотонічного розчину, виготовленого із вибраної речовини:
а) 0,291 моль/л; б) 0,150 моль/л;
в) 0,200 моль/л; г) 0,403 моль/л.
5) Розрахувати масу вибраної речовини необхідної для приготування 600 мл ізотонічного розчину.
а) 15,54 г; б) 32,72 г; в) 62,17 г; г) 21,5 г.
4.17. Для полоскання горла використовують розчин соди(NaHCO3) 1 чайна ложка (5 г) на стакан води (200г)
1) Концентрація одержаного розчину:
а)2,44%; б)5,2%; в) 2,5%; г) 1,5%.
2) Одержаний розчин створює осмотичний тиск, який можна розрахувати за формулою:
а) 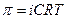 ; б)
; б) 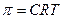 ;
;
в) 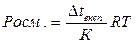 ; г)
; г) 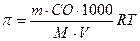 .
.
3)Яка молярна концентрація одержаного розчину (ρ = 1,05 г/мл):
а) 0,48 моль/л; б) 0,313 моль/л;
в) 0,205 моль/л; г) 0,410 моль/л.
4) Одержаний розчин в органінізмі створює осмотичний тиск:
а) 2730,5 кПа; б) 748,65 кПа;
в) 2994,62 кПа; г) 1614,8 кПа.
5) Цей розчин є:
а) ізотонічний; б) гіпертонічний;
в) гіпотонічний; г) фізіологічний.
4.19. При виконанні науково-дослідної роботи необхідно приготовити буферний розчин, який відповідає значенню рН=6,8.
1) Які з наведених буферних сумішей підходять для приготування такого розчину?
а) Na2HPO4 і NaH2PO4;
б) NH4OH і NH4Cl;
в) Н2СО3 і NaHCO3;
г) СН3СООН і СН3СООNa.
2) Розрахувати об’єми розчинів, які необхідні для приготування 100 мл буферної системи з рН=6,8, якщо молярні концентрації еквівалентів вихідних розчинів 0,1 моль/л (К=6,2∙10-8)
а) V1= 28 мл V2=72 мл
б) V1= 25 мл V2=75 мл
в) V1= 30 мл V2=70 мл
г) V1= 35 мл V2=65 мл
3) Визначити, як зміниться рН даного буферного розчину, (рН=6,8), якщо до нього додати 10 мл кислоти з молярною концентрацією еквівалентів 0,1 моль/л.
а) рН = 6,8; б) рН = 7,1;
в) рН = 6,55 г) рН = 4,5.
4) Одержаний буферний розчин можна віднести до буферів:
а) кислотних; б) основних;
в) нейтральних; г) амфотерних.
5) Які основні протолітичні процеси відбуваються при дії на буферну систему сильної кислоти чи лугу:
а) електролітична дисоціація, протоліз, нейтралізація;
б) електролітична дисоціація, протоліз, гідроліз;
в) гідроліз, протоліз, нейтралізація;
г) окислення, гідроліз, протоліз.
4.20. При наданні допомоги в умовах надзвичайної ситуації в лікарні закінчився фізіологічний розчин. Для одержання фізіологічного розчину було вирішено приготувати його.
1) Які із наявних речовин можна використати для одержання фізіологічного розчину:
а) кухонна сіль; б) цукор;
в) хлорид магнію; г) сульфат кальцію.
2) Осмотичний тиск крові людини:
а)800-850 кПа; б) 720-740 кПа;
в) 740-780 кПа; г) 350-400 кПа.
3) Для розрахунку концентрації речовини, з якої можна отримати розчин можна використати формулу:
а) 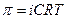 б)
б) 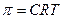
в) 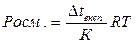 г)
г) 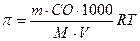
4) Розрахувати молярну концентрацію вихідної речовини:
а) 0,300; б) 0,303; в) 0,148; г) 0,140.
5) Скільки грам вихідної речовини необхідної взяти для того, щоб одержати 5 літрів фізіологічного розчину.
а) 45,10 г; б) 43,29;
в) 90,5 г; г) 112,72 г.
4.21. Для дослідження кислотно-основного стану крові у пацієнта було взято пробу 5 мл крові, з якою були проведені аналізи.
1) На визначення буферної ємності даної крові за кислотою провели титрування 2 мл крові розчином HCl з С=0,01 моль/л і на зміну рН від 7,36 до 6,9 було витрачено 1,5 мл розчину HCl. Розрахувати буферну ємність.
а) ВК = 0,016; б) ВК = 0,25;
в) ВК = 0,0015; г) ВК = 0,15.
2) На визначення буферної ємності даної крові за основою провели титрування 2 мл крові розчином NaOH з С=0,02 моль/л і на зміну рН від 7,36 до 8,4 було витрачено 3,5 мл розчину NaOH. Розрахувати буферну ємність.
а) ВО = 0,035; б) ВО =0,067;
в) ВО =0,033; г) ВО =0,040.
3) Визначити скільки мл розчину NaOH з С=0,01 моль/л треба додати до 20 мл крові, щоб змінити її рН від 7,45 до 8,4, якщо В0=0,01.
а) Vo = 10 мл; б) Vo =19 мл;
в) Vo = 8,5 мл; г) Vo = 11 мл.
4) Механізм дії на гідрокарбонатну буферну систему кислотою представлений в рівнянні:
а) Нb- + H3O+↔HHb + H2O;
б) H3O+ + OH- ↔ 2H2O;
в) HPO4-2 + H3O+ ↔ H2PO4- + H2O;
г) H3O+ + HCO3- ↔ H2CO3 + H2O.
5) Які буферні системи забезпечують гомеостаз людського організму.
а) гемоглобінові, фосфатна, гідрокарбонатна, білкова;
б) гемоглобінові, фосфатна, гідрокарбонатна, ацетатна;
в) гемоглобінові, фосфатна, амонійна, білкова;
г) гемоглобінові, ацетатна, амонійна, білкова.
4.22. При дослідженні якості питної води одним із показників є її твердість
1) Твердість води обумовлена присутністю у воді розчинених солей. Які із наведених сполук обумовлюють тимчасову твердість води?
а) Са(НСО3)2; Мg(HCO3)2;
б) СаCl2, MgCl2., CaSO4, MgSO4;
в) СаСО3; МgCO3 MgSO4, CaSO4;
г) Мg(НCO3)2, СаCl2, MgSO4, CaSO4.
2) Для визначення тимчасової твердості води використовують реакцію нейтралізації 50 мл досліджуваної води в присутності метилоранжу робочим розчином НСl (СЕ=0,1 моль-екв/ л) До досягнення точки еквівалентності витратилося 2,2 мл розчину НСl. Тимчасова твердість води:
а) Ттимч. =3,0 ммоль –екв/ л;
б) Ттимч. =4,4 ммоль –екв/ л;
в) Ттимч. =5,8 ммоль –екв/ л;
г) Ттимч. =3,0 ммоль –екв/ л;
3) Загальну твердість води визначають комплексонометрично. На титрування 5 мл досліджуваної води в присутності амонійного буферу і хромогену темно синього до досягнення точки еквівалентності витратилося 4,3 мл стандартного розчину трилону Б (СЕ=0,01 моль-екв/ л)Яка загальна твердість води?
а) Т заг. =10,4 ммоль-екв/л;
б) Т заг. =13,0 ммоль-екв/л;
в) Т заг. =8,6 ммоль-екв/л;
г) Т заг. =12,4 ммоль-екв/л.
4) Досліджувана вода має постійну твердість:
а) Тпост =7,4 ммоль-екв/ л;
б) Тпост =8,6 ммоль-екв/ л;
в) Тпост =4,2 ммоль-екв/ л;
г) Тпост =9,4 ммоль-екв/ л.
5) На основі проведених досліджень і за шкалою твердості досліджувана вода є:
а) м’ якою, непридатною для пиття;
б) твердою, придатною для пиття;
в) середньої твердості, придатною для пиття;
г) дуже твердою, непридатною для пиття.
4.23. В хірургічній практиці використовують розчини, які сприяють виведенню із гнійних ран продуктів розкладу.
1) Для цього необхідно використати розчин:
а) ізотонічний; б) гіпертонічний;
в) гіпотонічний; г) фізіологічний.
2) Який з наявних в лікарні розчинів найкраще використати для цього:
а) 0,9%-ний р-н NaCl;
б) 10%-ний р-нMgSO4;
в) 5%-ний р-н глюкози;
г) 5%-ний р-н NaCl
3) Розрахувати масу солі необхідної для приготування 200мл такого розчину (ρ = 1,12 г/мл)
а) 10,5 г; б) 33,4 г; в) 11,2 г; г) 22,4 г.
4) Молярна концентрація цього розчину:
а) 0,09 моль/л; б) 0,96 моль/л;
в) 0,05 моль/л; г) 0,5 моль/л.
5) Розрахуйте осмотичний тиск одержаного розчину та вкажіть, який процес буде проходити при введенні цього розчину в кров:
а) 1680 кПа гемолізу; б) 780 кПадифузії;
в)3878 кПа плазмолізу; г) 1350 кПа гемолізу.
4.24. При клінічному дослідженні шлункового соку визначено його рН= 1,65. Розрахувати:
1)Яка концентрація йонів водню в шлунковому соці?
а) 2,24 ∙ 10-2; б) 1,12 ∙ 10-4;
в) 2,12 ∙ 10-3; г) 1,84 ∙ 10-2.
2) Яка концентрація гідроксид-йонів в цьому соці?
а) 2,23∙10-6; б) 2,87∙10-8;
в) 4,47∙10-13; г) 1,13∙10-8.
3) У скільки разів необхідно зменшити концентрацію йонів водню, щоб збільшити величину рН даного соку на одиницю?
а) у 5 разів; б) у 10 разів;
в) у 7 разів; г) у 3 рази.
4) Як зміниться величина рН даного шлункового соку коли до 10 мл його додати 10 мл розчину NaOH з концентрацією С=0,01 моль/ л?
а) збільшиться; б)зменшиться;
в) не зміниться; г) різко зменшиться.
5) Чи зміниться величина рН даного шлункового соку, коли до 10 мл його додати 10 мл розчину HCl з концентрацією С=0,02 моль/л?
а) збільшиться; б) не зміниться;
в) зменшиться; г) різко зросте.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 849; Нарушение авторских прав?; Мы поможем в написании вашей работы!