
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електричні та акустичні явища
|
|
|
|
Регуляція роботи серця
Автомати серця
Певна частина серцевого м'яза спеціалізується на видачі решти серця керуючих сигналів у формі відповідних електричних імпульсів. Ці частини м'язової тканини названі збудливо-провідною системою. Основний її частиною є синусно-передсердний вузол, званий водієм ритму, поміщений на зводі правого передсердя. Він управляє частотою роботи серця шляхом відправки регулярних електричних імпульсів. Електричний імпульс через колії в м'язі передсердя надходить в передсердно-шлунковий вузол. Збуджений вузол посилає імпульс далі, в окремі клітини м'язи, викликаючи їх скорочення. Збудливо-провідна система забезпечує ритмічну роботу серця за допомогою синхронізованого скорочення передсердь і шлуночків.
Робота серця регулюється нервовою і ендокринною системами, а також іонами Ca і K, які містяться в крові. Робота нервової системи над серцем полягає в регуляції частоти і сили серцевих скорочень (симпатична нервова система зумовлює посилення скорочень, парасимпатична - послаблює). Робота ендокринної системи над серцем полягає у виділенні гормонів, які посилюють або послаблюють серцеві скорочення. Основний залозою виділення гормонів, які регулюють роботу серця, є наднирники. Вони виділяють гормони адреналін і ацетилхолін, функції яких відносно серця відповідають функціям симпатичної і парасимпатичної систем. Таку ж роботу виконують відповідно іони Ca і K.
При роботі серця (як і будь м'язи) відбуваються електричні явища, які викликають появу електромагнітного поля навколо працюючого органу. Електричну активність серця можна зареєструвати за допомогою спеціальних електродів, накладених на певні ділянки тіла. За допомогою електрокардіографа отримують електрокардіограму (ЕКГ) - картину змін у часі різниці потенціалів на поверхні тіла. ЕКГ відіграє важливу роль в діагностиці інфаркту та інших захворювань серцево-судинної системи.
|
|
|
Акустичні явища, звані тонами серця, можна почути, прикладаючи до грудної клітки вухо або стетоскоп. Кожен серцевий цикл в нормі поділяють на 4 тони. Вухом при кожному скороченні чутні перші 2. Більш довгий і низький пов'язаний із закриттям дво-і тристулкового клапанів, більш короткий і високий - це закриваються клапани аорти та легеневої артерії. Між одним і другим тоном йде фаза скорочення шлуночків.
19. Ідеа́льний газ (рос. идеальный газ; англ. ideal gas, нім. ideales Gas n) — це газ, в якому молекули можна вважати матеріальними точками, а силами притягання й відштовхування між молекулами можна знехтувати. У природі такого газу не існує, але близькими за властивостями до ідеального газу є реальні розріджені гази, тиск в яких не перевищує 200 атмосфер і які перебувають при не дуже низькій температурі, оскільки за таких умов відстань між молекулами набагато перевищує їх розміри.
20. Дифу́зія — процес випадкового невпорядкованого переміщення частинок під впливом хаотичних сил, зумовлених тепловим рухом і взаємодією з іншими частками.
Дифузія — перенесення речовини, зумовлене вирівнюванням її концентрації (точніше, хімічного потенціалу) у спочатку неоднорідній системі.
Теплопрові́дність — здатність речовини переносити теплову енергію, а також кількісна оцінка цієї здатності: фізична величина, що характеризує інтенсивність кондуктивного теплообміну в речовині, яка дорівнює відношенню густини теплового потоку до градієнта температури[1].
Явище теплопровідності полягає в тому, що кінетична енергія атомів й молекул, яка визначає температуру тіла, передається атомам і молекулам у тих областях тіла, де температура нижча.
|
|
|
Теплопровідність не єдиний шлях, яким тепло передається від тіла з вищою температурою, до тіла з нижчою температурою. Така теплопередача може також відбуватися за рахунок теплового випромінювання і конвекції. Різниця між теплопровідністю й конвекцією в тому, що при конвекції тепло переноситься разом із речовиною, а при теплопровідності переносу речовини немає.
При теплопровідності величина потоку тепла визначається різницею температури між різними областями тіла. Кількісно теплопровідність характеризується коефіцієнтом теплопровідності 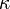 , який входить в рівняння (закон Фур'є)
, який входить в рівняння (закон Фур'є)
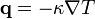 .
.
Тут 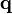 — тепловий потік, T — температура,
— тепловий потік, T — температура,  — оператор Гамільтона набла, яким позначається градієнт.
— оператор Гамільтона набла, яким позначається градієнт.
Коефіцієнт теплопровідності вимірюється у Вт/(м·K) або Вт·м-1·K-1.
Тертя́ — сукупність явищ, що спричиняють опір рухові одне відносно одного макроскопічних тіл (зовнішнє тертя) або елементів одного і того ж тіла (внутрішнє тертя), при якому механічна енергія розсіюється переважно у вигляді тепла. Зовнішнє тертя відбувається на границі контакту двох твердих тіл. Внутрішнє тертя виникає у потокахрідини або при деформації твердого тіла, між частинами, що переміщуються одна відносно одної.
Зовнішнє тертя (тертя) — явище опору відносному переміщенню, яке виникає між двома тілами в зонах контакту їх поверхонь, тангеціально до них. (ДСТУ 2823-94)
Сила, що виникає у результаті тертя має назву — сила тертя.
21. Реа́льний газ (рос. реальный газ; англ. real gas, нім. reales Gas n, Realgas n) — газ, для якого термічнерівняння стану є відмінним від Клапейрона-Менделєєва.
На формі залежностей між його параметрами відбивається те, що молекули його взаємодіють між собою та займають певний об'єм.
Рівняння Ван дер Ваальса — модельне рівняння стану неідеального газу.
 .
.
де P — тиск, V — об'єм, N — число молекул, T — температура, kB — стала Больцмана, a та b — характерні для кожного реального газу сталі, які будуть визначені нижче.
Рівняння ван дер Ваальса описує збільшення тиску при зменшенні об'єму розріджених газів, перенасичену пару, перегріту рідину, різке зменшення стисливості в рідкійфазі. Рівняння ван дер Ваальса визначає також критичну температуру, вище якої газ не зріджується при жодному тиску. Фактично рівняння Ван дер Ваальса описує різницю між станом реального та ідеального газів. Поправки a і b мають більше значення при високих тисках газів. Наприклад, для азоту при тиску порядку 80 атм розрахунки проведені за рівняннями ідеального та реального газів різняться приблизно на 5%, а при тиску порядку 400 атм різниця складає вже 100%.
|
|
|
22. Поверхне́вий на́тяг — фізичне явище, суть якого в прагненні рідини скоротити площу своєї поверхні при незмінному об'ємі.
Характеризується коефіцієнтом поверхневого натягу.
Завдяки силам поверхневого натягу краплі рідини приймають максимально близьку до сферичної форми, виникає капілярний ефект, деякі комахи можуть ходити по воді.
Поверхневий натяг виникає як у випадку поверхні розділу між рідиною й газом, так і у випадку поверхні розділу двох різних рідин.
Своєю появою сили поверхневого натягу завдячують поверхневій енергії.
Для зменшення сил поверхневого натягу використовуються поверхнево-активні речовини.
Газова емболія – явище попадання бульбашки повітря в кровоносну судину малого діаметру і закупорка її, тобто повна зупинка руху крові по судині.
Газова емболія - захворювання, що виникає внаслідок прориву стінок альвеол з капілярами, що приводить до виносу повітряних бульбашок в кровоносне русло. Кров приносить їх у серце, звідки вони потрапляють в артерії великого кола кровообігу і досягають життєво важливих органів, перешкоджаючи нормальному їх кровопостачанню і пошкоджуючи стінки кровоносних судин.
Попадання бульбашок в мозок викликає втрату свідомості, порушення зору, слуху, координації, руху, параліч. Попадання повітря в коронарні артерії призводить до інфаркту міокарда. Гази в підшкірних судинах викликають появу на шкірі червоно-білих плям («мармуровий» малюнок шкіри).
Газова емболія є найсерйознішою формою баротравми легенів. Вона характеризується ушкодженням легенів і пульмонарних капілярів з наступним проникненням бульбашок газу в кровоносне русло.
|
|
|
23. Капілярний ефект - явище підвищення або зниження рівня рідини у капілярах в порівнянні з тим значенням, яке вимагає закон сполучених посудин.
Капілярний ефект виникає через зниження або збільшення тиску рідини під меніском, який утворюється при змочуванні рідиною стінок капіляра.
Величина підвищення або зниження h залежить від радіуса капіляра r, а також від кута змочування рідиною стінок 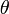
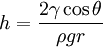 ,
,
де 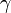 - коефіцієнт поверхневого натягу рідини,
- коефіцієнт поверхневого натягу рідини, 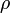 - густина рідини, g - прискорення вільного падіння.
- густина рідини, g - прискорення вільного падіння.
Приклад капілярного ефекту - всмоктування розлитої води серветкою.
Формула Жюрена — формула, определяющая высоту поднятия жидкости в капиллярах.
Формула имеет следующий вид:
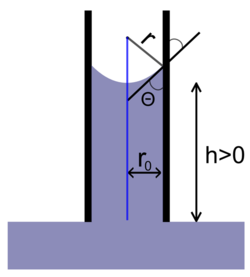

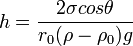
где:
§ h — высота поднятия столба жидкости
§ 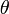 — угол смачивания жидкостью стенки капилляра
— угол смачивания жидкостью стенки капилляра
§ g — ускорение свободного падения
§ 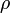 — плотность жидкости
— плотность жидкости
§  — плотность газовой фазы
— плотность газовой фазы
§ r0 — радиус капилляра
Чем меньше радиус капилляра r0, тем на большую высоту поднимается в ней жидкость. Высота поднятия столба жидкости растет также с увеличением коэффициента поверхностного натяжения жидкости.
При отсутствии смачивания  , и уровень жидкости в капилляре опускается на величину h. При полном смачивании
, и уровень жидкости в капилляре опускается на величину h. При полном смачивании 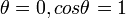 , и радиус мениска равен радиусу капилляра.
, и радиус мениска равен радиусу капилляра.
24.
25 Вологість - міра насиченості речовини водою.
26. Вн́утрішня ене́ргія тіла (позначається як E або U) — повна енергія термодинамічної системи за винятком її кінетичної енергії як цілого і потенціальної енергії тіла в полі зовнішніх сил. Внутрішня енергія складається з кінетичної енергії хаотичного руху молекул, потенціальної енергії взаємодії між ними і внутрішньомолекулярної енергії.
Внутрішня енергія є однозначною функцією рівноважного стану системи. Це означає, що кожний раз, коли система опиняється в даному рівноважному стані, її внутрішня енергія приймає властиве цьому стану значення, незалежно від передісторії системи. Отже, зміна внутрішньої енергії при переході з одного стану в інший буде завжди дорівнювати різниці значень в цих станах, незалежно від шляху, по якому здійснювався перехід. Внутрішню енергію тіла не можна виміряти напряму. Можна визначити тільки зміну внутрішньої енергії:
 ,
,
де 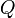 — кількість теплоти, передана термодинамічній системі,
— кількість теплоти, передана термодинамічній системі, 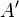 — робота, виконана над термодинамічною системою[1] або:
— робота, виконана над термодинамічною системою[1] або:
 ,
,
де 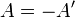 , робота виконана термодинамічною системою.
, робота виконана термодинамічною системою.
Пе́рший зако́н термодина́міки — одне з основних положень термодинаміки, є, по суті, законом збереження енергії у застосуванні дотермодинамічних процесів. Перший закон термодинаміки сформульований в середині 19 століття в результаті робіт Саді Карно, Юліуса фон Маєра, Джеймса Прескотта Джоуля і Германа фон Гельмгольца. Перший початок термодинаміки часто формулюють як неможливість існування вічного двигуна 1-го роду, який здійснював би роботу, не черпаючи енергію з якого-небудь джерела.
[ред.]Перший закон термодинаміки
Зміна внутрішньої енергії закритої системи, яка відбувається в рівноважному процесі переходу системи із стану 1 в стан 2, дорівнює сумі роботи, зробленої над системою зовнішніми силами, і кількості теплоти, наданої системі: ΔU = A' + Q. Робота здійснена системою над зовнішніми тілами в процесі 1->2 (Назвемо її просто А) A=-A', тоді закон приймає вигляд:
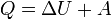 .
.
Кількість теплоти, що надається системі, витрачається на зміну внутрішньої енергії системи і на здійснення системою роботи проти зовнішніх сил.
Для елементарної кількості теплоти δQ; елементарної роботи δA і малої зміни dU внутрішньої енергії перший закон термодинаміки має вигляд:

27. Рівняння Пуассона - неоднорідне еліптичне рівняння в часткових похідних другого порядку.
Зокрема, в електростатиці рівняння, яке описує потенціал електричного поля 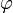 в системі зарядів, заданих густиною
в системі зарядів, заданих густиною 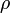
28. Дру́гий закон термодина́міки — один із основних законів фізики, закон про неспадання ентропії в ізольованій системі. Він накладає обмеження на кількість корисної роботи, яку може здійснити тепловий двигун. На засадничому рівні другий закон термодинаміки визначає напрямок протікання процесів у фізичній системі - від порядку до безпорядку. Існує багато різних формулювань другого закону термодинаміки, загалом еквівалентних між собою. Формулювання
Для системи із сталою температурою існує певна функція стану S — ентропія, яка визначається таким чином, що
1. Адіабатичний перехід із рівноважного стану A в рівноважний стан B можливий лише тоді, коли
 .
.
2. Приріст ентропії в повільному квазістатичному процесі дорівнює
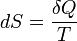 ,
,
де T — температура.
Теплові машини — машини призначені для перетворення внутрішньої енергії палива на механічну енергію. Механічна енергія згодом може перетворитись на електричну енергію й будь-які інші види енергії. У більшості сучасних теплових машин механічну роботу здійснює газ, що розширюється в процесі нагрівання. Цей газ називають робочим тілом. Найпоширенішими тепловими машинами є теплові двигуни.
29. Ентроп́ія S — в термодинаміці міра енергії у термодинамічній системі, яка не може бути використана для виконання роботи. Вона також є мірою безладдя, присутнього в системі.
Поняття ентропії
Поняття ентропії було вперше введено у 1865 році Рудольфом Клаузіусом. Він визначив зміну ентропії термодинамічної системи при оборотному процесі як відношення загальної кількості теплоти ΔQ, отриманої або втраченої системою, до величини абсолютної температури T:

Рудольф Клаузіус дав величині S назву «ентропія», утворивши її від грецького слова τρoπή, «зміна» (зміна, перетворення).
Рівність відноситься саме до зміни ентропії. У термодинаміці ентропія визначається лише з точністю до сталої.
Зв'язок між теплоємністю та ентропією дається формулою
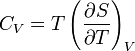
[ред.]Статистичне визначення ентропії: принцип Больцмана
У 1877 році, Людвіг Больцман зрозумів зв'язок між ентропією системи та кількістю можливих «мікростанів» (мікроскопічних станів), якими може реалізуватися макроскопічний стан із заданими властивостями. Розглянемо, наприклад, ідеальний газ у посудині. Мікростан визначений як положення та імпульси кожного атома, з яких складається система. Братимемо до уваги тільки ті мікростани, для яких: (i) розташування всіх частинок не виходить за межі посудини, (ii) загальна енергія газу, що визначається як сума кінетичних енергій атомів, дорівнює певній величині. Больцман постулював що
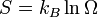
де константа kB=1,38·10-23 Дж/К відома тепер як стала Больцмана, а  є числом мікроскопічних станів, можливих у заданому макроскопічному стані. Цей постулат, відомий як принцип Больцмана, може розцінюватися, як початок статистичної механіки, яка описує термодинамічні системи використовуючи статистичну поведінку компонентів, із яких вони складаються. Принцип Больцмана зв'язує мікроскопічні властивості системи (Ω) з однією з її термодинамічних властивостей (S).
є числом мікроскопічних станів, можливих у заданому макроскопічному стані. Цей постулат, відомий як принцип Больцмана, може розцінюватися, як початок статистичної механіки, яка описує термодинамічні системи використовуючи статистичну поведінку компонентів, із яких вони складаються. Принцип Больцмана зв'язує мікроскопічні властивості системи (Ω) з однією з її термодинамічних властивостей (S).
Згідно з визначенням Больцмана, ентропія є функцією стану. Більш того, оскільки (Ω) може бути тільки натуральним числом (1,2,3.), ентропія повинна бути додатньою — виходячи з властивостей логарифма.
У випадку дискретних станів квантової механіки підрахунок кількості станів не викликає проблем і проводиться звичайним чином. Складніше підрахувати кількість станів у рамках класичної механіки, в рамках якої мікроскопічний стан системи описується координатами 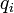 й імпульсами
й імпульсами 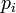 окремих частинок, що пробігають неперервні значення. Для підрахунку станів у класичних системах фазовий простір розбивають на невеликі комірки із об'ємом, який відповідає зведеній сталій Планка. В такому випадку
окремих частинок, що пробігають неперервні значення. Для підрахунку станів у класичних системах фазовий простір розбивають на невеликі комірки із об'ємом, який відповідає зведеній сталій Планка. В такому випадку
 ,
,
де  — число незалежних координат,
— число незалежних координат, 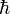 — зведена стала Планка, а інтегрування проводиться по області фазового простору, який відповідає певному макроскопічному стану.
— зведена стала Планка, а інтегрування проводиться по області фазового простору, який відповідає певному макроскопічному стану.
30.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1346; Нарушение авторских прав?; Мы поможем в написании вашей работы!