
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Одержання алотропних модифікацій Оксигену та Сульфуру
|
|
|
|
1) Кисень утворюється в результаті розкладання деяких солей:

пероксидів: 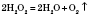
оксидів важких металів: 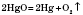
2) Озон утворюється зі звичайного кисню під дією електричного розряду (розряд блискавки, робота електротрансформаторів) або ультрафіолетового випромінювання (сонячне світло, робота ксерокса), а також у процесах, що супроводжуються виділення атомарного Оксигену (розклад пероксидів).
3) Сірку добувають в самородному стані; також її добувають:
при неповному розкладанні сірководню:
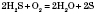
із сульфідів металів:
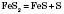
в реакціях відновлення сірки із сульфур(IV) оксиду:

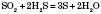
Хімічні властивості кисню.
Кисень — сильний окисник.
1) Взаємодія з металами:
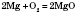
2) Взаємодія з неметалами:
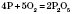
3) Горіння складних речовин:

4) Окиснення складних речовин (цей процес не належить до горіння):
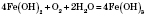
Хімічні властивості сірки.
1) При взаємодії з неметалами сірка виявляє окисні й відновлювальні властивості.
Із простими речовинами, утвореними більш електронегативними елементами (Оксигеном, Фтором, Хлором, Бромом), сірка виступає в ролі відновника.
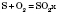 — сульфур(IV) оксид
— сульфур(IV) оксид
Із простими речовинами, утвореними менш електронегативними елементами, сірка виступає в ролі окисника:
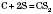 — карбон(VI) сульфід
— карбон(VI) сульфід
Бінарні сполуки сульфуру, в яких вона виявляє ступінь окиснення –2, називають сульфідам и.
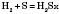 — гідроген сульфід (сірководень)
— гідроген сульфід (сірководень)
2) Взаємодія з металами.
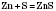 — цинк сульфід;
— цинк сульфід;
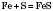 — ферум(ІІ) сульфід.
— ферум(ІІ) сульфід.
Усі сульфіди, крім HgS, утворюються при нагріванні. Із ртуттю сірка взаємодіє вже при кімнатній температурі:
 — меркурій(II) сульфід.
— меркурій(II) сульфід.
Ця властивість використовується в лабораторіях для видалення розлитої ртуті, пари якої дуже токсичні.
Застосування кисню. Кисень використовується для інтенсифікації процесів горіння (наприклад, при виплавці сталі), підвищення температури горіння (при зварюванні), як окисник в інших реакціях, у медицині.
Озон має дезинфікуючу відбілюючу дію. Головне застосування озону — знезаражування водопровідної води.
Застосування сірки. Сірка застосовується для одержання сульфатної кислоти, вулканізації каучуку, боротьби із сільськогосподарськими шкідниками, одержання сірників, пороху. У медицині виготовляють сірчані мазі для лікування шкірних хвороб.
|
|
|
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 440; Нарушение авторских прав?; Мы поможем в написании вашей работы!