
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сульфід водню. Сульфіди
|
|
|
|
Однією з найважливіших сполук сірки є сульфід водню H2S (сірководень). Він утворюється при взаємодії сірки з воднем при високій температурі:
Н2 + S«H2S.
Однак ця реакція оборотна, тому незручна для практичного використання. У лабораторії для одержання сірководню застосовують реакцію витіснення сірководню із сульфіду заліза(ІІ) хлороводневою кислотою;
FeS + 2HC1 = FeCl2 + H2S.
Сульфід водню — це безбарвний газ, трохи важчий за повітря, з неприємним запахом тухлих яєць. Він дуже токсичний. Молекула H2S має кутову будову, HSH = 92°. У зв'язку з тим, що величина відносної електронегативності сірки в 1,4 раза менша, ніж кисню, між молекулами сірководню виникають слабкі міжмолекулярні водневі зв'язки. Сірководень легко скраплюється у безбарвну рідину з t пл.=-60,35 °С.
У воді H2S добре розчинний: при 20 °С в одному об'ємі води розчиняється 2,58 об'ємів H2S, при цьому утворюється ≈ 0,1 М розчин, який називають сірководневою водою.
Сульфід водню в розчині поводиться як слабка двохосновна кислота:
Н2S + Н2О ® Н3О+ + НS- ; К1= 1 • 10-8,
HS- + H2O ® H3O+ + S2- K2 = 10-14.
Оскільки друга константа дисоціації сірководневої кислоти (K2) мала, в розчинах іонних сульфідів присутні, в основному, HS— -ioни; S2--ioни існують лише в дуже лужних розчинах з концентрацією 8М NаОН.
Водний розчин сірководню утворює два ряди солей: середні — сульфіди та кислі — гідросульфіди. У воді розчинні лише сульфіди лужних та лужноземельних металів, а також амонію.
У розчині сульфіди гідролізуються як солі, утворені сильною основою та слабкою двохосновною кислотою з утворенням лужного середовища:
Na2S + H2O ® NaHS + NaOH.
Сульфіди неметалічних елементів гідролізуються незворотньо, утворюючи відповідні кислоти:
|
|
|
SiS2 + ЗН2О = H2SiО3 + 2H2S.
Деякі сульфіди (АІ2S, Cr2S3, Fe2S3) також гідролізуються незворотньо з утворенням слабкої нерозчинної у воді основи та слабкої, нестійкої у водному розчині кислоти:
A12S3 + 6Н2О = 2А1(ОН)3 + 3H2S.
Такі сульфіди можна одержати лише «сухим» шляхом при сплавленні металічних ошурок із сіркою, утворення їх у водному розчині неможливе.
Більшість сульфідів металів — малорозчинні сполуки, добуток розчинності яких знаходиться у межах 10-10 — 10-52. Низьку розчинність та характерне індивідуальне забарвлення, а також різну розчинність у кислотах використовують в хімічному аналізі.
Прагнення сірки до утворення гомоланцюгів проявляється в існуванні полісульфідів водню (сульфанів) H2Sn та полісульфідів активних металів, наприклад Na2Sn. В структурі цих сполук існують ланцюги атомів сірки.
Одержують полісульфіди взаємодією сірки з сульфідами лужних металів сплавленням або в концентрованому розчині:
Na2S + 2S = Na2S3.
Суміш сульфанів у вигляді жовтої маслянистої рідини утворюється взаємодією хлороводневої кислоти з полісульфідами:
Na2Sn + 2HC1 = H2Sn + 2NaCl.
В молекулах полісульфідів число атомів сірки складає 2-9, частіше n = 2. Наприклад, досить поширений мінерал пірит FeS2 є персульфідом заліза(ІІ)

Сульфіди, як похідні найнижчого ступеня окиснення сірки, виявляють лише відновні властивості. Продуктами їх окиснення, в залежності від умов, можуть бути S, SO2, H2SO4.
Для визначення продуктів окиснення сульфідів слід пам'ятати такі закономірності:
Дією на H2S водних розчинів більшості окисників (КМnО4, K2Cr2О7, H2SO4(K), НNО3(к)) він окиснюється до вільної сірки:
5Н2 S-2 + 2КМnО4 + 3H2SO4 = 5S 0+ 2MnSO4 + K2SO4 + 8Н2О.
Спалюванням сірководню в надлишку кисню утворюється SO2:
2H2S-2 +ЗО2 = 2S+4О2 + 2Н2О.
Дуже сильні окисники (Cl2, Br2, PbO2, NaCIO, HNO3(дим)) окиснюють сірководень до сірчаної кислоти
Н2S-2 + 4С12 + 4Н2О = Н2S+6O4+ 8HC1.
Кисневмісні сполуки сірки(ІV)
Оксид сірки(ІV) SO2 утворюється при спалюванні сірки у повітрі:
|
|
|
S + О2 = SO2
У лабораторії SO2 одержують дією концентрованої сірчаної кислоти на мідь:
Сu + 2H2SO4(K) = CuSO4 + SO2 ↑+ 2Н2О
або дією хлороводневої кислоти на сульфіти:
Na2SO3 + 2НС1 = 2NaCl + SO2 ↑+ Н2О.
У процесі промислового виробництва сірчаної кислоти SO2 одержують випалюванням піриту:
4FeS2 + 11О2 = 2Fe2O3 + 8SO2↑.
SO2 — безбарвний газ у 2,2 раза важчий за повітря з запахом палених кісток, легко скраплюється.
Молекула оксиду сірки(ІV) має кутову будову:
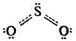
У цьому оксиді атомні орбіталі сірки знаходяться у стані sρ2-гібридизації, про що свідчить величина валентного кута, близька до 120°.
Діоксид сірки добре розчиняється у воді: при 0 °С в одному об'ємі води міститься 80 об'ємів SО2 а при кімнатній температурі — 40 об'ємів SO2. При цьому утворюється сірчиста кислота H2SO3 середньої сили, яка існує лише в розчині (К1=2 10-2, К2=6 ▪ 10-8).
Солі сірчистої кислоти — сульфіти та гідросульфіти — одержують взаємодією SO2 з розчинами лугів або розчинними карбонатами:
SO2 + NaOH = NaHSO3,
SO2 + 2NaOH = Na2SO3 + H2O,
2SO2 + Na2CO3 + H2O = 2NaHSO3 + CO2↑.
Оскільки сірка в SO2 та сульфітах знаходитеся у проміжному ступені окиснення (+4), ці сполуки виявляють окисно-відновну двоїстість з більш вираженими відновними властивостями.
Якщо пропускати SO2 через йодну воду, то вона миттєво знебарвлюється внаслідок відновлення І2 до І-;
SO2 + І2 + 2Н2О = H2SO4, + 2HI.
Гідросульфіт натрію під назвою «антихлор» використовують для видалення залишків хлору після використання його як відбілювача:
NaHSO3 + С12 + Н2О = NaHSO4 + 2HC1.
З сильними відновниками сірчиста кислота виступає окиснювачем і відновлюється до елементної сірки:
2H2S + H2SO3 = 3S + ЗН2О.
При нагріванні сульфіти диспропорціонують:
4Na2SO3 = Na2S + 3Na2SO4.
Продукти цієї реакції легко виявити за допомогою якісних реакцій на сульфід- та сульфат-іони.
Похідне сірки(ІV) — тіонілхлорид SOCl2 одержують за реакцією:
SO2 + РС15 = РОС13 + SOC12.
SOC12 — безбарвна рідина з різким запахом, подразнює слизові оболонки очей та носоглотки. Тіонілхлорид використовують в органічній хімії для одержання хлорангідридів карбонових кислот
Він активно реагує з водою, утворюючи суміш хлороводневої та сірчистої кислот:
SOCl2 + 2Н2О = 2НС1 + H2SO3
Кисневмісні сполуки сірки(VI)
При підвищеній температурі в присутності каталізатора V2O5 оксид сірки (IV) окиснюється киснем до оксиду сірки(VІ):
|
|
|
2SO2 + О2 = 2SO3.
| У рідкому стані оксид сірки(УІ) існує у вигляді тримера (sp3-гШ|>идизація АО сірки): |
| У твердому стані SO3 утворює полімерні зигзагоподібні ланцюги: |
Оксид сірки(VІ) у вигляді молекули перебуває лише в газоподібному стані. Атомні орбіталі сірки в ній знаходять в стані sp2-гібридизації;

У рідкому стані оксид сірки (VІ) існує у вигляді тримера (sp3-гібридизація АО сірки):

У твердому стані SО3 утворює полімерні зигзагоподібні ланцюги:
Твердий оксид сірки(VІ) — це білі шовковисті кристали.
Оксид сірки(VІ) активно реагує з водою, утворюючи сірчану кислоту:
SO3 + Н2О = H2SO4.
Промисловий спосіб одержання H2SO4 базується на поглинанні SO3 концентрованою сірчаною кислотою (ні в якому разі не водою), при цьому утворюється суміш полісірчаних кислот, яку називають олеум. Склад олеуму можна представити формулою Н2SO4 ▪ nSO3 (n = 1—6). Олеум (у перекладі з латинської «масло») це в’язка важка рідина. При розведенні олеуму розчином сірчаної кислоти одержують концентровану (96 %) H2SO4. Інколи використовують також сірчану кислоту з масовою часткою 100 %, яка має назву моногідрат (SO3 * Н2О). Моногідрат практично не проводить електричний струм, оскільки молекули H2SO4 не можуть дисоціювати у відсутності розчинника (Н2О зв'язана).
Концентрована сірчана кислота — в'язка, важка, нелетка рідина (р = 1,86 г/см3, Тпл =10 °С, Ткип = 340 °С). Для приготування розчину H2SO4 її слід обережно лити тонким струменем у воду (не навпаки!) при інтенсивному перемішуванні розчину, який розігрівається й закипає, тому розведення необхідно здійснювати лише в термостійкому посуді.
H2SO4 — сильна двохосновна кислота (К2=1,3 • 10-2), для якої характерні дегідратуючі властивості. Спорідненість H2SO4 з водою настільки велика, що концентрована кислота не тільки зв'язує вільну воду, але й відбирає її у різних сполук, внаслідок чого вони обвуглюються. Наприклад, цукор під дією H2SO4(K) чорніє, при цьому відчувається запах паленого цукру. Причиною цього є його часткова карамелізація.
|
|
|
Концентрована сірчана кислота — сильний окисник. За нормальних умов вона не взаємодіє лише з платиновими металами та золотом, а також із залізом, алюмінієм, хромом та деякими іншими металами (пасивує їх). Концентрована кислота окиснює метали, що стоять правіше водню в електрохімічному ряді напруг (мідь, срібло, ртуть), а також багато неметалів, відновлюючись при цьому до SO2:
Hg + 2H2SO4(к)= HgSO4 + SO2 + 2H2O,
C + 2H2SO4(к)= CO2 + 2SO2 + 2H2O.
Взаємодією з активними металами сірка (+6) відновлюється до SO2, S або H2S. Так, в залежності від кількісних співвідношень, H2SO4. відновлюється цинком до різноманітних продуктів:
Zn + 2Н2S+6О4(к) = ZnSO4 + S+4 О2 + 2Н2О,
3Zn + 4Н2S+6О4(к) - 3ZnSO4 + S0 + 4Н2О,
4Zn + 5H2S+6O4(K) = 4ZnSO4 + H2S-2 + 4Н2О.
З галогенід-іонами H2SO4(K) реагує по-різному. Хлорид-іон нею не окиснюється, а бромід- та иодид-іони окиснюються до вільних Вг2 та І2, при цьому SO4- відновлюється відповідно до SO2 тa H2S:
2KBr(T) + 2H2SO4(K) = Вґ2 + SO2 + K2SO4 + 2H2O,
8KI(T) + 5H2SO4(K) = 4І2 +.H2S+ 4K2SO4 + 4H2O.
Розведена сірчана кислота виявляє характерні властивості сильних кислот. Вона реагує з основними та амфотерними оксидами, гідроксидами, основами, деякими солями, розчиняє метали, розміщені в електрохімічному ряді напруг лівіше водню, утворюючи сульфати металів та водень:
Zn + H2SO4(p) = ZnSO4.+ H2↑.
Сірчана кислота утворює два ряди солей: сульфати та гідросульфати, більшість з яких добре розчинні у воді. Малорозчинні лише сульфати барію, стронцію, кальцію та свинцю.
Оксид сірки(VІ) на світлі легко окиснюється хлором, це окиснення супроводжується приєднанням хлору:
SO2+ С12 = SO2C12.
Внаслідок реакції утворюється безбарвна рідина, яка димить на повітрі — сульфурил хлорид. Останній використовують як хлоруючий агент органічних сполук. В гарячій воді він розкладається на дві кислоти:
SO2C12 + 2Н2О = H2SO4 + 2HC1.
Взаємодією оксиду сірки(VІ) з хлороводнем одержують хлор-сульфонову кислоту:
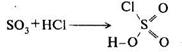
HSO3C1 — рідина, яка димить на повітрі, tпл = -80 °С, tкип = +150 °С (з розкладанням). Використовують її у синтезі лікарських препаратів сульфаніламідного ряду (стрептоцид, норсульфазол та ін.)-
Взаємодією хлорсульфонової кислоти з пероксидом водню одержують пероксомоносірчану кислоту (кислоту Каро) — H2SO5:
H-О-SO2 -СІ + H-О-О-Н ® Н-О-SО2-О-О-Н +НСІ.
Пероксодисірчану кислоту H2S2O8 одержуюсь у промисловості анодним окисненням гідросульфат-іона. Пероксидисірчана кислота та її солі пероксосульфати — дуже сильні окисники, але лише в присутності каталізатора Ag+.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1783; Нарушение авторских прав?; Мы поможем в написании вашей работы!