
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Короткі теоретичні відомості. З усіх типів хімічного зв’язку в молекулах найбільш поширеним є ковалентний зв’язок, який утворюється внаслідок перекривання АО з неспареними електронами
|
|
|
|
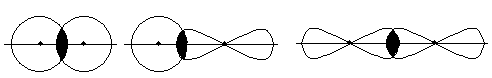 З усіх типів хімічного зв’язку в молекулах найбільш поширеним є ковалентний зв’язок, який утворюється внаслідок перекривання АО з неспареними електронами взаємодіючих атомів. У першу чергу виникає так званий s- зв’язок, коли АО перекриваються вздовж прямої лінії - лінії зв’язку, що з’єднує ядра взаємодіючих атомів:
З усіх типів хімічного зв’язку в молекулах найбільш поширеним є ковалентний зв’язок, який утворюється внаслідок перекривання АО з неспареними електронами взаємодіючих атомів. У першу чергу виникає так званий s- зв’язок, коли АО перекриваються вздовж прямої лінії - лінії зв’язку, що з’єднує ядра взаємодіючих атомів:
s - s s - p p - p
Деякі молекули мають дві області перекривання атомних орбіталей, які знаходяться над і під площиною, де знаходяться ядра взаємодіючих атомів та s- зв’язки, таким чином додатково виникає так званий p- зв’язок:

p - р p – d d – d
Усі s-зв’язки багатовалентного атома однакові, тобто цей атом має на АО однотипні валентні електрони. У випадку різнотипних валентних електронів відбувається гібридизація відповідних електронних орбіталей. Гібридні орбіталі мають лише таку форму:
Розглянемо основні типи гібридизації АО. Якщо атом двохвалентного елемента має валентні електрони ns 2 np  p
p  або ns 2 np
або ns 2 np  p
p  p
p  , тобто якщо два неспарені електрони розташовані на орбіталях одного типу (р), гібридизація відсутня. Молекула у цьому випадку кутова, значення валентного кута дорівнює 90° і співпадає з розташуванням р -орбіталей у просторі. Якщо ж атоммає у збудженому стані ns
, тобто якщо два неспарені електрони розташовані на орбіталях одного типу (р), гібридизація відсутня. Молекула у цьому випадку кутова, значення валентного кута дорівнює 90° і співпадає з розташуванням р -орбіталей у просторі. Якщо ж атоммає у збудженому стані ns  np
np  -валентні електрони, то вихідні АО – різних типів, тому відбувається sp- гібридизація. Треба знати, що гібридні АО розташовуються у просторі під максимальними кутами одна до іншої; у цьому випадку – під кутом 180°. Отже, молекула лінійна.
-валентні електрони, то вихідні АО – різних типів, тому відбувається sp- гібридизація. Треба знати, що гібридні АО розташовуються у просторі під максимальними кутами одна до іншої; у цьому випадку – під кутом 180°. Отже, молекула лінійна.
 | |||
 |

90°
гібридизація відсутня sp -гібридизація
Для атомів трьохвалентних елементів з неспареними електронами, розташованими на ns  np
np  p
p  p
p  -підрівнях (нормальний стан) або ns
-підрівнях (нормальний стан) або ns 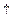 np
np  p
p  -підрівнях (збуджений стан іншого атома), не відбувається ніякої гібридизації у першому випадку, тому що вихідні АО однотипні, та відбувається sp 2-гібридизація АО у другому випадку. Отже, перша молекула має геометричну форму тригранної піраміди з валентним кутом 90° у вершині, тому що р -орбіталі розташовані у просторі під цим кутом одна до іншої. Друга молекула являє собою рівносторонній трикутник, тому що максимальний кут між трьома гібридизованими орбіталями дорівнює 120°:
-підрівнях (збуджений стан іншого атома), не відбувається ніякої гібридизації у першому випадку, тому що вихідні АО однотипні, та відбувається sp 2-гібридизація АО у другому випадку. Отже, перша молекула має геометричну форму тригранної піраміди з валентним кутом 90° у вершині, тому що р -орбіталі розташовані у просторі під цим кутом одна до іншої. Друга молекула являє собою рівносторонній трикутник, тому що максимальний кут між трьома гібридизованими орбіталями дорівнює 120°:
|
|
|
 | |||
 |
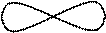
90°
гібридизація відсутня sp 2-гібридизація
Для атома чотирьохвалентного елемента, в якого валентні електрони у збудженому стані знаходяться на ns 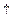 np
np  p
p  p
p  -підрівнях, наявні sp 3-гібридизаціяао та тетраедрична форма молекули з валентним кутом 109°28¢ (» 109,5°):
-підрівнях, наявні sp 3-гібридизаціяао та тетраедрична форма молекули з валентним кутом 109°28¢ (» 109,5°):
 |
sp 3-гібридизація
При розв’язанні задач цього розділу потрібно розуміти різницю між полярністю зв’язку та полярністю молекули у цілому.Полярність зв’язкупов’язана з наявністю ефективних (реальних) зарядів (d±) на атомах після утворення ковалентного зв’язку. Найпростіше вона оцінюється за різницею електронегативностей атомів (ЕН, або c, див. додаток, табл.1). Якщо ця різниця (DЕН) менша за 1,9, утворюється ковалентний полярний зв’язок, наприклад:
С 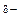 - Н
- Н  , С
, С  – Cl
– Cl  , C0 - S0
, C0 - S0
DЕН 0,4 0,5 0
полярні зв’язки неполярний зв’язок
При  ЕН > 1,9 утворюється іонний зв’язок, який можна розглядати як граничний варіант ковалентного полярного зв’язку.
ЕН > 1,9 утворюється іонний зв’язок, який можна розглядати як граничний варіант ковалентного полярного зв’язку.
При наявності полярних зв’язків молекула у залежності від її будови може бути як полярною, так і неполярною. Якщо центри всіх позитивних і негативних зарядів співпадають у просторі, молекула неполярна; якщо не співпадають – молекула полярна. Так, молекули типу АВ2 трикутної форми полярні, молекули типу АВ2 лінійної форми неполярні.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 348; Нарушение авторских прав?; Мы поможем в написании вашей работы!