
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Короткі теоретичні відомості. При розв’язанні задач цього розділу потрібно пам’ятати, що реакції у розчинах речовин-електролітів проходять у бік утворення слабких електролітів
|
|
|
|
При розв’язанні задач цього розділу потрібно пам’ятати, що реакції у розчинах речовин-електролітів проходять у бік утворення слабких електролітів, зовнішніми ознаками яких можуть бути осади, гази, вода та інші слабкі електроліти.
У задачах крім молекулярного рівняння також необхідно писати повне йонно-молекулярне, а потім - скорочене йонно-молекулярне рівняння цієї ж реакції. У повному йонно-молекулярному рівнянні сильні електроліти записують в іонному вигляді, тому що вони існують у цьому розчині майже повністю як іони; слабкі електроліти записують у вигляді молекул, бо вони майже зовсім не розкладаються на іони. Після скорочення справа і зліва однакових іонів можна одержати скорочене йонно-молекулярне рівняння реакції. Наприклад:
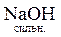 +
+ 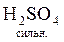 =
= 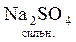 +
+  ;
;
2Na+ + 2OH+ + 2H+ + SO 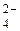 = 2Na+ + SO
= 2Na+ + SO 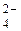 + 2H2O;
+ 2H2O;
2H+ + 2OH- = 2H2O;
H- + OH- = H2O.
Якщо слабкі електроліти є і в правій, і в лівій частинах рівняння, реакцію (мається на увазі пряма реакція) можна довести до кінця додаванням надлишку розчину сильного електроліту (однієї з вихідних речовин) згідно з принципом Ле Шательє. Так, нейтралізація розчину амоніаку надлишком сульфатної кислоти відбувається за рівняннями:
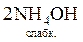 +
+  =
= 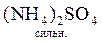 +
+  ;
;
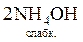 + 2H+ + SO
+ 2H+ + SO 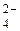 = 2NH
= 2NH  + SO
+ SO 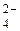 +
+  ;
;
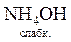 + H+ Û NH
+ H+ Û NH  +
+ 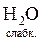 , або
, або
NH3 + H+ Û NH  .
.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 288; Нарушение авторских прав?; Мы поможем в написании вашей работы!