
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Короткі теоретичні відомості. Електрохімічними називають хімічні процеси, які відбуваються за рахунок підведеної ззовні електричної енергії
|
|
|
|
ЕЛЕКТРОХІМІЧНІ ПРОЦЕСИ. ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ
Електрохімічними називають хімічні процеси, які відбуваються за рахунок підведеної ззовні електричної енергії, або, навпаки, самі є джерелом її утворення.
Вихідним поняттям у електрохімії є поняття про електродний потенціал (j), який вимірюють у вольтах. j - кількісна величина, що характеризує здатність окисно-відновної системи до окиснення та відновлення. Чим менше її значення, тим легше окислюється відновлена форма системи (Red); чим воно більше, тим легше проходить процес відновлення окисленої форми (Ox).
Рівняння Нернста характеризує залежність j від природи окисно-відновної системи, концентрації потенціалутворюючих іонів і температури. Для стандартних умов рівняння Нернста має вигляд:
jOx/Red = j0Ox/Red + 
 ,
,
де j0Ox/Red - стандартний електродний потенціал системи,
z - число електронів у електродній реакції,
[Ox], [Red] – концентрації окисленої та відновленої форм системи відповідно.
Для металічних електродів рівняння Нернста спрощується до:
j = j0 +  [Me z +],
[Me z +],
а для водневого електрода:
j 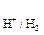 = 0,059lg[H+] = - 0,059pH.
= 0,059lg[H+] = - 0,059pH.
Гальванічний елемент – це технічний пристрій, в якому енергія окисно-відновної реакції безпосередньо перетворюється на електричну за рахунок розділення у просторі процесів окиснення (анод) і відновлення (катод). Необхідно пам’ятати, що  >
>  . Електрорушійна сила гальванічного елемента (ЕРС, або просто Е) розраховується як різниця потенціалів:
. Електрорушійна сила гальванічного елемента (ЕРС, або просто Е) розраховується як різниця потенціалів:
ЕРС =  -
-  .
.
Приклад. Складіть схему гальванічного елемента, утвореного пластинками з цинку та заліза, зануреними у розчини солей цих металів з концентраціями відповідно 0,01 і 0,1 моль/л. Запишіть рівняння електродних реакцій та сумарної струмоутворюючої реакції. Розрахуйте ЕРС гальванічного елемента.
|
|
|
Розв’язання. Для визначення анода та катода у більшості випадків достатньо скористатись значеннями стандартних електродних потенціалів (див. додаток, табл.4):
 = - 0,76 B <
= - 0,76 B <  = - 0,44 B, тому анодом є цинк.
= - 0,44 B, тому анодом є цинк.
Рівняння анодного процесу:
А(-): Zn0 - 2 e = Zn2+.
Анод негативно заряджений відносно зовнішнього електричного кола.
Рівняння катодного процесу:
К(+): Fe2+ + 2 e = Fe0.
Катод позитивно заряджений відносно зовнішнього електричного кола.
Якщо скласти два рівняння, одержимо рівняння сумарної струмоутворюючої реакції в іонно-молекулярному вигляді:
Zn2+ + Fe0 = Zn0 + Fe2+,
або у молекулярному вигляді:
ZnSO4 + Fe = Zn + FeSO4.
Схема гальванічного елемента записується так:
Zn0 | Zn2+ || Fe2+ |Fe0.
Вертикальною рискою позначено межу між електродом та електролітом, двома рисками – межу поділу між електролітами (пориста перегородка).
Розраховуємо значення потенціалів анода та катода згідно з рівнянням Нернста:
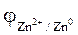 = - 0,76 +
= - 0,76 +  = - 0,76 +
= - 0,76 +  » - 0,82 В,
» - 0,82 В,
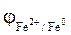 = - 0,44 +
= - 0,44 + 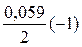 » - 0,47 В.
» - 0,47 В.
Тоді
ЕРС =  -
- 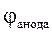 = - 0,47 - (- 0,82) = 0,35 В.
= - 0,47 - (- 0,82) = 0,35 В.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 308; Нарушение авторских прав?; Мы поможем в написании вашей работы!