
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
IV. Додатки
Окисно-відновні реакції
Лабораторна робота №6
Мета роботи – дослідити властивості типових окисників і відновників
1. Окисні властивості сульфатної кислоти.
1. У дві пробірки налийте 5-6 крапель концентрованої сульфатної кислоти (обережно!). В одну з них опустіть гранулу цинку, в іншу – мідь. Вміст пробірок трохи нагрійте (витяжна шафа!). До отвору кожної пробірки піднесіть смужку фільтрувального паперу, змоченого розчином нітрату плюмбуму (ІІ) Pb(NO3)2. Одна зі смужок паперу повинна почорніти внаслідок виділення сірководню та утворення чорного сульфіду плюмбуму PbS:
Pb(NO3)2 + H2S = PbS¯+ 2HNO3.
Який газ виділяється з іншої пробірки? Складіть рівняння реакцій, вкажіть атом-окисник та атом-відновник.
2. Подійте розведеною сульфатною кислотою на мідь і цинк. У якому разі і чому реакція не перебігає? Атом якого елемента у молекулі кислоти є окисником? Складіть рівняння реакцій.
2. Окисні властивості іонів металу.
1. У пробірку налийте 2-3 краплі розчину хлориду феруму (ІІІ) FeCl3 та додайте такий самий об’єм розчину іодиду калію KI. Чому змінився колір розчину? Складіть рівняння реакцій, враховуючи, що продукт відновлення – іон Fe2+.
2. У дві пробірки налийте 2-3 мл розчину нітрату плюмбуму (ІІ). В одну з пробірок занурте гранулу цинку, а в іншу – міді. На якому з металів осаджується свинець і чому? Складіть рівняння реакцій.
Використовуючи спостереження, розташуйте іони цинку, міді та плюмбуму в порядку зменшення їх окислювальних властивостей.
3. Окисно-відновна двоїстість пероксиду гідрогену
1. Налийте у пробірку декілька крапель розчину перманганату калію KMnO4. Додайте» 1 мл розчину сульфатної кислоти і по краплях додавайте розчин пероксиду гідрогену Н2О2 до знебарвлення розчину. Яку роль відіграє пероксид гідрогену в цій реакції – окисника чи відновника?
KMnO4 + Н2О2 + H2SO4 ® MnSO4 + О2 + K2SO4 + Н2О.
2. Налийте у пробірку» 1 мл розчину іодиду калію і такий самий об’єм розчину розведеної сульфатної кислоти. Додайте декілька крапель пероксиду гідрогену. Що при цьому спостерігається? Яку роль відіграє пероксид гідрогену в цій реакції – окисника чи відновника?
KІ + Н2О2 + H2SO4 ® І2 + K2SO4 + Н2О.
У наведених рівняннях розставте коефіцієнти методом електронного балансу.
Додаток 1
Відносна електронегативність s - та p -елементів
| H 2,1 | ||||||
| Li 2,1 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | О 3,5 | F 4,0 |
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,2 | S 2,5 | Cl 3,0 |
| K 0,8 | Ca 1,0 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 |
| Rb 0,8 | Sr 1,0 | In 1,7 | Sn 1,8 | Sb 1,9 | Te 2,1 | I 2,5 |
| Cs 0,7 | Ba 0,9 | Tl 1,8 | Pb 1,8 | Bi 1,9 | Po 2,0 | At 2,2 |
| Fr 0,7 | Ra 0,9 |
Додаток 2
Стандартні ентальпії  утворення деяких речовин
утворення деяких речовин
| Речовина |  , кДж/моль , кДж/моль
| Речовина |  , кДж/моль , кДж/моль
|
| CH4(г.) | -74,85 | Н2О(г.) | -241,83 |
| C3H8(г.) | -103,9 | Н2О(рід.) | -285,84 |
| CH3OH(рід.) | -201,2 | Н2S(г.) | -21,00 |
| CO(г.) | -110,52 | NH3(г.) | -46,19 |
| СО2(г.) | -393,51 | NH4Cl(тв.) | -315,39 |
| СS2(г.) | 115,3 | NO(г.) | 90,37 |
| Fe2O3(тв.) | -822,2 | P2O5(г.) | -2984,0 |
| FeSO4(тв.) | -927,6 | SО2(г.) | -296,9 |
| HCl(г.) | -92,31 |
Додаток 3
Стандартні енергії Гіббса 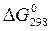 утворення деяких речовин
утворення деяких речовин
| Речовина | 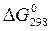 , кДж/моль , кДж/моль
| Речовина | 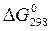 , кДж/моль , кДж/моль
|
| BaO(тв.) | -577,6 | СО2(г.) | -394,0 |
| BaCO3(тв.) | -1235,4 | CH4(г.) | -51,00 |
| BeO(тв.) | -582,0 | Fe2O3(тв.) | -740,8 |
| BeCO3(тв.) | -945,0 | Н2О(г.) | -228,6 |
| CaO(тв.) | -604,0 | NH3(г.) | -17,0 |
| CaCO3(тв.) | -1129,0 | NO(г.) | 87,0 |
| CO(г.) | -137,0 | NO2(г.) | 52,0 |
Додаток 4
Стандартніпотенціали j0 металічних електродів
| Метал | Електродна реакція | j0, B | Метал | Електродна реакція | j0, B |
| Li | Li+ + e  Li Li 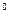
| -3,05 | Cd | Cd2+ + 2 e  Cd Cd
| -0,40 |
| K | K+ + e  K K
| -2,92 | Co | Co2+ + 2 e  Co Co
| -0,28 |
| Ва | Ba2+ +2 e  Ва Ва
| -2,91 | Ni | Ni2+ + 2 e  Ni Ni
| -0,25 |
| Ca | Ca2+ + 2 e  Сa Сa
| -2,87 | Sn | Sn2+ + 2 e  Sn Sn
| -0,14 |
| Na | Na+ + e  Na Na
| -2,71 | Pb | Pb2+ + 2 e  Pb Pb
| -0,13 |
| Mg | Mg2+ +2 e  Mg Mg
| -2,27 | Fe | Fe3+ + 3 е  Fe Fe
| -0,04 |
| Be | Ве2+ + е  Be Be
| -1,85 | H | 2H+ + 2 e  H H
| 0,0 |
| Al | Аl3+ + 3 е  Аl Аl
| -1,66 | Cu | Cu2+ + 2 e  Cu Cu
| +0,34 |
| Ті | Ti2+ +2 e  Ті Ті
| -1,63 | Ag | Ag+ + e  Ag Ag
| +0,80 |
| Mn | Mn2+ + 2 e  Mn Mn
| -1,18 | Hg | Hg2+ + 2 e  Hg Hg
| +0,85 |
| Zn | Zn2+ + 2 e  Zn Zn
| -0,76 | Pt | Pt2+ + 2 e  Pt Pt
| +1,19 |
| Cr | Сг2+ +3 е  Cr Cr
| -0,71 | Au | Аu3+ + 3 е  Au Au
| +1,42 |
| Fe | Fe3+ + 3 e  Fe Fe
| -0,44 |
Додаток 5
Розчинність солей та основ у воді
| Аніони | Na+ | K+ | NH4+ | Cu2+ | Ag+ | Mg2+ | Ca2+ | Ba2+ | Zn2+ | Al3+ | Sn2+ | Pb2+ | Cr3+ | Fe3+ |
| Cl- | P | Р | Р | Р | Н | P | Р | Р | Р | Р | Р | М | Р | Р |
| Br- | Р | Р | Р | Р | Н | Р | Р | Р | Р | Р | Р | М | Р | Р |
| I- | P | Р | Р | - | Н | Р | Р | Р | Р | Р | Р | Н | P | - |
| NO3- | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | Р |
| CH3COO- | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | - | - |
| S2- | P | Р | Р | Н | Н | - | Р | Р | Н | - | Н | Н | - | Н |
| SO32- | P | Р | Р | Н | Н | Н | Н | Н | Н | - | - | Н | - | - |
| SO42- | P | Р | Р | Р | М | Р | М | Н | Р | Р | Р | Н | Р | Р |
| CO32- | P | Р | Р | - | Н | Н | Н | Н | H | - | - | Н | - | - |
| SiO32- | P | Р | - | - | - | Н | Н | Н | Н | Н | - | Н | - | Н |
| PO43- | Р | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| OH- | Р | Р | Р | Н | - | Н | М | Р | Н | Н | Н | Н | Н | Н |
|
|
Дата добавления: 2015-05-24; Просмотров: 397; Нарушение авторских прав?; Мы поможем в написании вашей работы!