
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модуль. 2. Кількісний аналіз 5 страница
|
|
|
|
A. Появі жовтого забарвлення
B. Появі рожево-фіолетового забарвлення
C. *Появі синього забарвлення
D. Зникненню рожево-фіолетового забарвлення
E. Зникненню синього забарвлення
288. Методом йодометрії визначають:
A. Сильні основи
B. *Окисники
C. Відновники
D. Лужні метали
E. Сильні кислоти
289. За вимогами ДФУ в йодометрії розчин титранту стандартизують за:
A. *Калій броматом
B. Натрій хлоридом
C. Натрій тіосульфатом
D. Калій дихроматом
E. Крохмалем
290. За вимогами ДФУ в йодиметрії розчин титранту стандартизують за:
A. Калій броматом
B. Натрій хлоридом
C. *Натрій тіосульфатом
D. Калій дихроматом
E. Крохмалем
291. Титрантом йодометрії є розчин.... з молярною концентрацією еквівалента...:
A. І2; 0,1 моль/л
B. І2; 0,0005 моль/л
C. КІ; 0,1 моль/л
D. Na2S2O3; 0,0005 моль/л
E. *Na2S2O3; 0,1 моль/л
292. Титрантом йодиметрії є розчин.... з молярною концентрацією еквівалента...:
A. *І2; 0,1 моль/л
B. І2; 0,0005 моль/л
C. КІ; 0,1 моль/л
D. Na2S2O3; 0,0005 моль/л
E. Na2S2O3; 0,1 моль/л
293. Виберіть титрант методу йодиметрії:
A. Нітрій гіпойод
B. Натрій тіосульфат
C. Йодат калію
D. *Йод
E. Калій йодид
294. Виберіть титрант методу йодометрії:
A. Натрій гіпойодит
B. *Натрій тіосульфат
C. Йодат калію
D. Йод
E. Калій йодид
295. Виберіть речовину, яку можна визначати зворотньою дихроматометрією:
A. Гліцерин
B. Арсеніти
C. Йодиди
D. Аскорбінову кислоту
E. *Нітрати
296. Виберіть речовину, яку можна визначати прямою дихроматометрією:
A. *Метанол
B. Нітрати
C. Бромати
D. Солі церію (IV)
|
|
|
E. Перманганати
297. Виберіть речовину, яку можна визначити прямою дихроматометрією:
A. Перхлорати
B. Нітрати
C. Перманганати
D. *Аскорбінову кислоту
E. Хлорати
298. Для розрахунку еквівалентної маси титранту в дихроматометрії необхідно молярну масу:
A. Поділити на 8
B. Помножити на 2
C. *Поділити на 6
D. Поділити на 2
E. Помножити на 6
299. Виберіть речовину, яку можна визначати зворотньою дихроматометрією:
A. Сульфіти
B. *Хлорати
C. Метанол
D. Аскорбінову кислоту
E. Гліцерин
300. Методом зворотньої дихроматометрії можна визначати крім всіх відновників ще і....
A. Речовини, що віддають електрони
B. Любі речовини незалежно від властивостей
C. І окисники, і відновники
D. Відновники
E. *Окисники
301. Методом прямої дихроматометрії можна визначати:
A. Речовини, що приймають електрони
B. Любі речовини незалежно від властивостей
C. І окисники, і відновники
D. *Відновники
E. Окисники
302. Дихроматометричне титрування проводять в присутності:
A. *Фосфатної кислоти
B. Нітратної кислоти
C. Дистильованої води
D. Дитизону
E. Калій гідроксиду
303. Титрантом дихроматометрії є:
A. Ацетатний розчин K2Cr2O7
B. Водний розчин KCr2O7
C. *Ацетатно-кислий розчин CrO3
D. Ацетатний розчин K2CrO4
E. Водний розчин Cr2O3
304. В методі дихроматометрії як внутрішній редокс-індикатор використовують:
A. *Дифеніламін
B. Метиловий червоний
C. Крохмаль
D. Фенолфталеїн
E. Лейкометиленовий голубий
305. В методі дихроматометрії як хемілюмінесцентний індикатор використовують:
A. Дифеніламін
B. Метиловий червоний
C. *Силоксен
D. Ферроїн
E. Лейкометиленовий голубий
306. В методі дихроматометрії як зовнішній редокс-індикатор використовують:
|
|
|
A. Дифеніламін
B. Метиловий червоний
C. Крохмаль
D. Ферроїн
E. *Лейкометиленовий голубий
307. Дихроматометричне титрування проводять в присутності:
A. Ацетатної кислоти
B. Аміачного буферного розчину
C. Натрій гідроксиду
D. Нітратної кислоти
E. *Хлоридної кислоти
308. Дихроматометричне титрування проводять в присутності:
A. Ацетатного буферного розчину
B. Фосфітної кислоти
C. *Сульфатної кислоти
D. Амоній гідроксиду
E. Нітратної кислоти
309. В дихроматометрії титрант стандартизують за:
A. Цинк сульфатом
B. *Його не стандартизують, оскільки це первинний стандартний розчин
C. Натрій карбонатом
D. Арґентум нітратом
E. Оксалатною кислотою
310. Для стандартизації титранту в методі дихроматометрії використовують:
A. H2C2O4
B. NaCl
C. HCl
D. KMnO4
E. *Його не стандартизують, оскільки це первинний стандартний розчин
311. Титрантом дихроматометрії є:
A. Водний розчин Cr2O3
B. Водний розчин KCrO2
C. Ацетатний розчин K2CrO4
D. *Водний розчин K2Cr2O7
E. Водний розчин KCr2O7
312. Виберіть титрант дихроматометрії:
A. Будь-яка сполука хрому (ІІІ)
B. *Хром триоксид в присутності льодяної ацетатної кисло
C. Хром (ІІІ) оксид
D. Хром (ІІ) сульфат
E. Хром (ІІІ) хлорид
313. Виберіть титрант дихроматометрії:
A. Калій тетрагідроксохроміт (ІІІ)
B. Калій хроміт
C. Хром (ІІІ) оксид в присутності льодяної ацетатної кислоти
D. Калій хромат
E. *Калій дихромат
314. Чому в перманганатометрії не використовують нітратнокисле середовище?
A. *Тому що нітратна кислота є сильним окисником
B. Тому що нітратна кислота належить до слабких кислот
C. Тому що нітрат-іони відновлюються титрантом
D. Тому що нітрат-іони окиснюються титрантом
E. Тому що нітратна кислота летка
315. При перманганатометрисному титруванні в хлориднокислому середовищі перед початком титрування до розчину додають:
A. Суміш MnSO4 + Н3РO4
B. Тільки H2SO4
C. Тільки НСl
D. *Суміш H2SO4+ MnSO4 + Н3РO4
E. Суміш H2SO4 + Н3РO4
316. При перманганатометричному титруванні в хлориднокислому середовищі перед початком титрування до нього додають:
|
|
|
A. Хлоридну кислоту
B. *Суміш Рейнгарда-Ціммермана
C. Суміш Діль-Копані
D. Суміш Рейнгарда-Крафтса
E. Таке титрування неможливе
317. Чому в перманганатометрії не використовують хлориднокисле середовище?
A. Тому що хлоридна кислота багатоосновна
B. Тому що хлорид-іони відновлюються титрантом
C. Тому що хлоридна кислота належить до слабких кислот
D. Тому що хлоридна кислота летка
E. *Тому що хлорид-іони окиснюються титрантом
318. Окисники перманганатометричним методом визначають:
A. Після створення лужного середовища
B. Після їх окиснення і створення лужного середовища
C. Після створення сульфатнокислого середовища
D. *Після їх відновлення і створення сульфатнокислого середовища
E. Після їх окиснення і створення сульфатнокислого середовища
319. Для кількісного визначення окисників методом перманганатометрії необхідно:
A. Одразу титрувати
B. Створити нітратнокисле середовище і провести титрування
C. *Спочатку окисник відновити, а потім провести титрування
D. Створити лужне середовище і провести титрування
E. Створити сульфатнокисле середовище і провести титрування
320. Методом прямої перманганатометрії не визначають:
A. *CeIV
B. Альдегіди
C. S2O32-
D. SO32-
E. NaNO2
321. Методом прямої перманганатометрії не визначають:
A. Сполуки з гідразо-групами
B. Карбонові кислоти
C. *BrO3
D. MgO2
E. H2O2
322. Для розрахунку маси гідроген пероксиду методом перманганатометрії необхідно використати формулу:
A. * 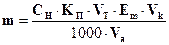
B. 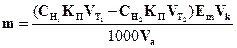
C. 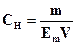
D. 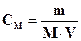
E. 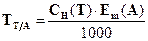
323. При кількісному визначенні гідроген пероксиду метод перманганатометрії титрування припиняють при:
A. Утворенні осаду синього кольору
B. Появі жовтого забарвлення
C. Утворенні осаду бурого кольору
D. Знебарвленні рожевого розчину
E. *Появі незникаючого рожевого забарвлення
324. Еквівалентна маса титранту в методі перманганатометрії розраховується за формулою:
|
|
|
A. М.М./1
B. М.м.·5
C. М.м.·3
D. *М.м./5
E. М.м./3
325. Безпосередньо розчином калій перманганату титрують:
A. Окисники
B. Тільки луги
C. *Відновники
D. Тільки кислоти
E. Тільки солі
326. Виберіть індикатор перманганатометрії:
A. Калій хромат
B. Кальконкарбонова кислота
C. Ферроїн
D. Метиловий оранжевий
E. *Це безіндикаторний метод
327. Для розрахунку еквівалентної маси калій перманганату в методі перманганатометрії необхідно молярну масу речовини:
A. Поділити на 1
B. *Поділити на 5
C. Поділити на 3
D. Помножити на 3
E. Помножити на 5
328. Прямою перманганатометрією можна проводити кількісне визначення:
A. Тільки кислот
B. Тільки окисників
C. Будь-яких речовин
D. І окисників, і відновників
E. *Тільки відновників
329. При проведенні перманганатометричного визначення речовин титрування припиняють:
A. При появі осаду коричнево-червоного кольору
B. При появі червоного забарвлення ферроїну
C. *При появі незникаючого блідо-рожевого забарвлення
D. При зміні забарвлення метилоранжу на жовтий
E. При появі блідо-жовтого забарвлення
330. В присутності якої речовини проводять кількісне визначення методом перманганатометрії?
A. Нітратної кислоти
B. Калій гідроксиду
C. Хлоридної кислоти
D. *Сульфатної кислоти
E. Натрій гідроксиду
331. В якому середовищі проводять перманганатометричне титрування?
A. Аміачному
B. Лужному
C. *Сульфатнокислому
D. Нейтральному
E. Нітратнокислому
332. Відповідно до вимог ДФУ розчин калій перманганату стандартизують за:
A. (NH4)2Fe(SO4)2∙6H2O
B. As2O3
C. Na2C2O4
D. H2C2O4∙2H2O
E. *Na2S2O3∙5H2O
333. Титрантом методу перманганатометрії є:
A. Первинний стандартний розчин MnO2
B. Вторинний стандартний розчин MnSO4
C. *Вторинний стандартний розчин KMnO4
D. Первинний стандартний розчин KMnO4
E. Первинний стандартний розчин MnSO4
334. Яку речовину не використовують для стандартизації розчину калій перманганату?
A. As2O3
B. KI
C. *As2O5
D. Na2C2O4
E. Na2S2O3∙5H2O
335. Яку речовину не використовують для стандартизації розчину калій перманганату?
A. Fe
B. *NH4Fe(SO4)2∙6H2O
C. H2C2O4∙2H2O
D. (NH4)2Fe(SO4)2∙6H2O
E. As2O3
336. Яку речовину не використовують для стандартизації розчину калій перманганату?
A. As2O3
B. (NH4)2Fe(SO4)2∙6H2O
C. Fe
D. *КСl
E. KI
337. Зміна забарвлення редокс-індикатора залежить від:
A. *Електродного потенціалу системи
B. Пряма залежність відсутня
C. Природи титранту
D. Природи реагуючої речовини
E. рН середовища
338. Які індикатори не використовують редоксиметрії?
A. Необоротні специфічні індикатори (метиловий оранжевий)
B. Зовнішні індикатори (йод крохмальний папірець)
C. Редокс-індикатори (ферроїн)
D. *Адсорбційні індикатори (еозин)
E. Специфічні (крохмаль, тіоціанат на йони феруму (ІІІ))
339. На величину стрибка титрування в редоксиметрії впливають:
A. рН середовища і величина константи стійкості комплексу
B. *Природа визначуваної речовини і титранта, хімічний склад розчину
C. Природа визначуваної речовини і титранта, величина ДР одержаного осаду
D. Тільки рН середовища
E. Природа визначуваної речовини і титранта, величина константи стійкості комплексу
340. Криву редоксиметричного титрування будують в координатах:
A. Ступінь відтитрованності - рХ (Х- концентрація визначуваного йону)
B. Об’єм визначуваної речовини - ступінь відтитрованності
C. Ступінь відтитрованності - рН середовища
D. Об’єм титранту - рН середовища
E. *Ступінь відтитрованності - електродний потенціал системи
341. Криву редоксиметричного титрування будують в координатах:
A. Ступінь відтитрованності - рН середовища
B. Об’єм титранту - рХ (Х- концентрація визначуваного йону)
C. Об’єм титранту - рН середовища
D. *Об’єм титранту - електродний потенціал системи
E. Об’єм визначуваної речовини - електродний потенціал системи
342. Непряму редоксиметрію використовують коли:
A. *Визначувана речовина і титрант не реагують
B. Реакція проходить стехіометрично
C. Константа рівноваги достатньо висока
D. Є можливість застосування конкретного способу фіксації кінцевої точки титрування
E. Взаємодія реагуючих речовин специфічна
343. Непряму редоксиметрію використовують коли:
A. Взаємодія реагуючих речовин специфічна
B. ЕРС≥0,4 В
C. *Реакція проходять нестехіометрично
D. Реакція проходить швидко
E. Константа рівноваги достатньо висока
344. Зворотню редоксиметрію використовують коли:
A. Реакція проходить стехіометрично
B. *Реакція проходить дуже повільно
C. Реакція проходить швидко
D. Взаємодія реагуючих речовин специфічна
E. ЕРС≥0,4 В
345. Пряме окисно-відновне титрування не використовують коли:
A. Взаємодія реагуючих речовин специфічна
B. ЕРС≥0,4 В
C. Константа рівноваги достатньо висока
D. *ЕРС≤0,4 В
E. Є можливість застосування конкретного способу фіксації кінцевої точки титрування
346. В окисно-відновному титруванні як індикатори використовують:
A. Індикатори, що в т.е. дають осад з титрантом
B. Всі методи даного титрування є безіндикаторними
C. рН-індикатори
D. Металохромні індикатори
E. *Редокс-індикатори
347. До вимог до реакцій в редоксиметрії не належить:
A. *Розчинність одержаного осаду повинна бути не більше 10-5 моль/л
B. Реакція повинна проходити необоротньо
C. Реакція повинна проходити стехіометрично
D. Реакція повинна проходити кількісно
E. Реакція повинна проходити швидко
348. Який з методів окисно-відновного титрування належить до методів редуциметрії:
A. Броматомерія
B. Нітритометрія
C. *Аскорбінометрія
D. Цериметрія
E. Йодатометрія
349. Який з методів окисно-відновного титрування належить до методів редуциметрії:
A. Броматометрія
B. *Хромометрія
C. Дихроматометрія
D. Йодиметрія
E. Йодатометрія
350. Який з методів окисно-відновного титрування не належить до методів оксидиметрії:
A. Хлорйодиметрія
B. Нітритометрія
C. Броматометрія
D. *Хромометрія
E. Дихроматометрія
351. Який з методів окисно-відновного титрування належить до методів редуциметрії:
A. Хлорйодиметрія
B. Нітритометрія
C. Перманганатометрія
D. Йодатометрія
E. *Титанометрія
352. Який з методів окисно-відновного титрування не належить до методів оксидиметрії:
A. Броматометрія
B. Нітритометрія
C. *Аскорбінометрія
D. Цериметрія
E. Йодатометрія
353. Який з методів окисно-відновного титрування не належить до методів оксидиметрії:
A. *Титанометрія
B. Хлорйодиметрія
C. Йодометрія
D. Дихроматометрія
E. Перманганатометрія
354. Титрування, в якому як титранти використовують відновники називається:
A. *Редуциметрія
B. Седиметрія
C. Комплексонометрія
D. Оксидиметрія
E. Алкаліметрія
355. Титрування, в якому як титранти використовують окисники називається:
A. Редуциметрія
B. Седиметрія
C. Комплексонометрія
D. *Оксидиметрія
E. Алкаліметрія
356. В основі методу редоксиметрії лежить реакція:
A. Обміну протонами
B. Обміну нейтронами
C. *Обміну електронами
D. Утворення малорозчинної сполуки
E. Утворення малодисоційованої сполуки
357. Титрування, в якому як титранти використовують окисники або відновники називається:
A. Алкаліметрія
B. *Редоксиметрія
C. Седиметрія
D. Комплексиметрія
E. Протолітометрія
358. До сильних окиснювачів, які легко вступають в окисно-відновні реакції, належать...
A. йод, бром, хром (ІІ) хлорид, натрій, кальцій
B. стрептоцид, левоміцетин, калій перманганат
C. анальгін, натрію хлорид, кальцій глюконат
D. калій перманганат, хлорамін, антибіотики, глікозиди, анальгін
E. *йод, перокисид водню, калій перманганат, аргентум нітрат, натрій нітрит
359. Кількісно водню пероксид визначають методом...
A. алкаліметрії
B. ацидиметрії
C. меркуриметрії
D. *перманганатометрії
E. комплексонометрії
360. Кількісне визначення формальдегіду, який є відновником, проводять методом...
A. титанометрії
B. комплексиметрії
C. трилонометрії
D. аскорбінометрії
E. *йодиметрії
361. Реактивами для визначення вмісту йоду в 10% розчині є...
A. сульфатна кислота, лакмус
B. нітратна кислота, фенолфталеїн
C. аміачна буферна суміш, хром темно-синій, трилон Б
D. *тіосульфат натрію, крохмаль
E. хлоридна кислота, метиловий оранжевий
362. З розчином йоду синє забарвлення утворює розчин...
A. реактиву Тромера
B. ферум-амонійного галуну
C. водню пероксиду
D. *крохмалю
E. ферум (ІІІ) хлориду
363. При кількісному визначенні первинних ароматичних амінів методом нітритометрії провізору-аналітику необхідно використати, як каталізатор - кристалічний:
A. Калій пербромат
B. Калій броміт
C. Калій гіпоброміт
D. Калій бромат
E. *Калій бромід
364. Реакція йодування органічних речовин за допомогою йод монохлориду протікає недостатньо швидко, тому для визначення, наприклад, етакридину лактату слід провести:
A. пряме або непряме титрування
B. пряме титрування
C. реверсивне титрування
D. непряме титрування
E. *зворотнє титрування
365. В методі хлорйодиметрії застосовують в якості титранту розчин йод монохлориду, який є:
A. вторинним стандартним розчином, що стандартизується за натрій сульфітом
B. первинним стандартним розчином
C. первинним, а може бути вторинним стандартним розчином
D. вторинним стандартним розчином
E. *вторинним стандартним розчином, що стандартизується за натрій тіосульфатом
366. В методі хлорйодиметрії застосовують в якості титранту розчин йод монохлориду, який є:
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2095; Нарушение авторских прав?; Мы поможем в написании вашей работы!