
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основи хімічної кінетики
|
|
|
|
Завдання № 5/4. Розрахунок констант хімічної рівноваги статистичним методом
Завдання № 5/3. Розрахунок термодинамічних функцій ідеального газу статистичним методом
З використанням формул (10) - (18) обчислити значення функцій 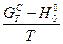 ,
, 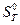 ,
, 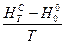 і
і  для певного ідеального газу за температури, вказаної викладачем.
для певного ідеального газу за температури, вказаної викладачем.
Довести, що константу хімічної рівноваги для реакції 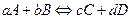 , яка протікає в газовій фазі, може бути обчислено за формулою:
, яка протікає в газовій фазі, може бути обчислено за формулою:
 , (19)
, (19)
де 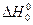 - тепловий ефект реакції за абсолютного нуля; Δν - різниця стехіометричних коефіцієнтів.
- тепловий ефект реакції за абсолютного нуля; Δν - різниця стехіометричних коефіцієнтів.
З використанням цієї формули обчислити константу хімічної рівноваги для реакції, вказаної викладачем за певної температури.
Основні поняття хімічної кінетики. Механізм реакції, прості та складні реакції. Швидкість реакції. Кінетичні криві. Кінетичні рівняння. Порядок реакції та методи його визначення. Константа швидкості реакції. Період напівперетворення. Молекулярність елементарних реакцій та її зв'язок з порядком реакції. Інтегрування кінетичних рівнянь для реакцій різних порядків.
Складні реакції. Паралельні реакції. Послідовні реакції. Метод стаціонарного стану. Оборотні реакції. Зв'язок між кінетикою та термодинамікою.
Молекулярно-кінетична теорія газів. Розподілення Максвелла-Больцмана. Середня та середньо-квадратична швидкості. Переріз зіткнення. Фактор зіткнення. Частота зіткнень. Довжина вільного пробігу.
Явища переносу в газах. Дифузія, теплопровідність, в'язкість газів. Ефузія. Теорія зіткнень в хімічній кінетиці. Активні зіткнення. Теорія Арреніуса. Залежність константи швидкості від температури, енергія активації та її експериментальне визначення.
Теорія перехідного стану (активного комплексу). Поверхня потенціальної енергії. Правило Поляні. Трансмісійний коефіцієнт. Статистичний розрахунок константи швидкості. Термодинамічний аспект теорії активного комплексу, ентропія активації.
Література: [1-7,9-11,14-16].
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 333; Нарушение авторских прав?; Мы поможем в написании вашей работы!