
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторна робота № 2.3
|
|
|
|
Визначення відношення теплоємностей повітря методом адіабатичного розширення
Мета роботи: визначити коефіцієнт Пуассона.
Теоретичні відомості
(Теорія до даної роботи описана в лекційному курсі (інтерактивного комплексу Ч І) §2.8-2.12)
Теплоємністю тіла називається фізична величина, що чисельно рівна кількості теплоти, яку необхідно надати тілу, щоб нагріти його на 1К. 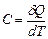 , де
, де  – кількість теплоти, необхідна для зміни температури тіла на
– кількість теплоти, необхідна для зміни температури тіла на 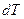 кельвінів.
кельвінів.
Питомою (молярною) теплоємністю називають кількість теплоти, яку необхідно надати одиниці маси (одному молю) речовини, щоб підвищити її температуру на 1К. Між питомою с та молярною С теплоємностями існує проста математична залежність
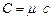 , (1)
, (1)
де 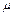 – молярна маса речовини.
– молярна маса речовини.
Згідно першого закону термодинаміки
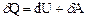 , (2)
, (2)
де  – кількість теплоти.
– кількість теплоти.
Елементарна робота розширення газу
 . (3)
. (3)
Елементарний приріст внутрішньої енергії
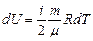 (4)
(4)
Розв’язуючи конкретні задачі термодинаміки найчастіше розглядають ізотермічний, ізобаричний, ізохоричний і адіабатичний процеси. Перший закон термодинаміки у застосуванні до таких процесів має вигляд:
ізотермічний процес T = const, 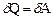 , (5)
, (5)
ізохоричний процес V =const,  , (6)
, (6)
ізобаричний процес P =const, 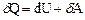 , (7)
, (7)
адіабатичний процес  =0,
=0,  . (8)
. (8)
Вираз роботирозширенняідеального для ізопроцесів має вигляд:
ізотермічний процес T = const 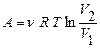 ,
,
ізохоричний процес V =const  ,
,
ізобаричний процес P =const, 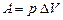 ,
,
адіабатичний процес  =0,
=0, 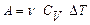 ,
,
де 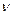 – кількість речовини (
– кількість речовини ( ).
).
Теплоємність газів істотно залежить від характеру передачі теплоти. Розрізняють теплоємності при сталому об’ємі  та при сталому тиску
та при сталому тиску 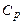 . Для ідеального газу.
. Для ідеального газу.
 , (5)
, (5) 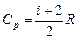 . (6)
. (6)
Відношення теплоємностей  та
та 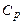 називається коефіцієнтом Пуассона
називається коефіцієнтом Пуассона  . (7)
. (7)
|
|
|
Визначення g для повітря є метою даної роботи.
З використанням формул (5) і(6) коефіцієнт Пуассона можна виразити через число ступенів вільності
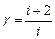 . (8)
. (8)
Перше рівняння системи рівнянь (9) є записом першого закону термодинаміки для адіабатного процесу, а друге – рівняння Менделєєва-Клапейрона.
 (9)
(9)
З розв’язку (9) одержимо рівняння адіабати (рівняння Пуассона)
 . (10)
. (10)
Опис установки та виведення робочої формули
Завдання 1.
Для експериментального визначення відношення 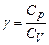 у газах можна скористатись установкою, суть якої зображена на рис. 1. Вона складається із посудини П, яка з’єднана з манометром М. Посудина сполучається з повітряним насосом через кран К 1 та з атмосферним повітрям через кран К 2.
у газах можна скористатись установкою, суть якої зображена на рис. 1. Вона складається із посудини П, яка з’єднана з манометром М. Посудина сполучається з повітряним насосом через кран К 1 та з атмосферним повітрям через кран К 2.
 На початку експерименту при відкритому крані К 1 і закритому К 2 потрібно накачати повітря у посудину. Після накачування кран К 1 закривається. Оскільки повітря при накачуванні нагрівається, то слід почекати деякий час доки воно не охолоне до кімнатної температури, за якої його тиск дорівнюватиме
На початку експерименту при відкритому крані К 1 і закритому К 2 потрібно накачати повітря у посудину. Після накачування кран К 1 закривається. Оскільки повітря при накачуванні нагрівається, то слід почекати деякий час доки воно не охолоне до кімнатної температури, за якої його тиск дорівнюватиме 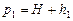 , де
, де 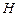 – атмосферний тиск,
– атмосферний тиск, 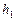 – надлишковий тиск, що показує манометр у міліметрах водяного стовпчика.
– надлишковий тиск, що показує манометр у міліметрах водяного стовпчика.
У другій частині експерименту короткочасно відкривають кран К 2, щоб тиск повітря у посудині зрівнявся з атмосферним р = Н, після чого кран К 2 знову закривають.
Внаслідок адіабатного розширення повітря у посудині охолоне (процес відбувається досить швидко). Тому у другій частині експерименту слід знову почекати деякий час доки температура повітря не стане кімнатною і його тиск дорівнюватиме 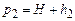 .
.
Наприкінці першої частини досліду виділимо уявно ту частину газу об’ємом V 1, яка після розширення (перед закриттям крану К 2) займе весь об’єм посудини V. На рис.1 ця частина виділена площинами АА і ВВ. Для адіабатного розширення газу від об’єму V 1 до V і запишемо рівняння Пуассона  . (11) Порівнюючи кінцевий стан газу, який залишився у посудині, із його початковим станом (перед відкриттям крану К 2), легко помітити, що обидва вони відносяться до однієї й тієї ж температури й описуються законом Бойля-Маріотта
. (11) Порівнюючи кінцевий стан газу, який залишився у посудині, із його початковим станом (перед відкриттям крану К 2), легко помітити, що обидва вони відносяться до однієї й тієї ж температури й описуються законом Бойля-Маріотта
|
|
|
 . (12)
. (12)
З останніх двох рівнянь можна виключити об’єми V і V 1, що не піддаються вимірюванню. Для цього слід рівняння (12) піднести до степеня  і поділити його на (11). У результаті одержимо
і поділити його на (11). У результаті одержимо  . Логарифмуючи останню рівність, знайдемо вираз для обчислення
. Логарифмуючи останню рівність, знайдемо вираз для обчислення 
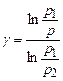 . (13)
. (13)
Підставивши у останню рівність значення 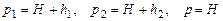 ,одержимо
,одержимо
 . (14)
. (14)
Оскільки величини 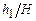 і
і  значно менші одиниці
значно менші одиниці 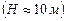 , то застосовуючи наближену математичну рівність
, то застосовуючи наближену математичну рівність  , яка справджується при
, яка справджується при  , одержимо робочу формулу
, одержимо робочу формулу
 . (15)
. (15)
Оскільки тиски 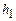 та
та  пропорціональні різницям рівнів рідини в манометрі, а у формулу (15) входять відношення цих тисків, то під
пропорціональні різницям рівнів рідини в манометрі, а у формулу (15) входять відношення цих тисків, то під 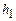 і
і  можна розуміти різницю рівнів води в манометрі.
можна розуміти різницю рівнів води в манометрі.
Хід роботи.
1. Закрити кран К 2.Грушею накачати в балон повітря стільки, щоб різниця рівнів води в манометрі була по можливості максимальною. Закрити кран К 1.
2. Через 2-3 хвилини, коли температура повітря в посудині стане рівною кімнатній (рівні води в колінах манометра уже не будуть змінюватись), знайти різницю рівнів води в колінах манометра h 1.
3. Відкрити на короткий час кран К 2 і як тільки тиск повітря у посудині дорівнюватиме атмосферному (рівні води в колінах манометра однакові),закрити кран К 2.
4. Через 2-3 хвилини, коли температура повітря в посудині стане рівною кімнатній (рівні води в колінах манометра уже не будуть змінюватись), знайти різницю рівнів води в колінах манометра h 2.
5. Дослід повторити 5 раз за пунктами 1-4.
6. Оцінити паспортні приладові похибки приладів 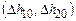 .
.
7. Обчислити за робочою формулою (15) коефіцієнт Пуассона g.
8. Визначити середнє значення g.
9. Обчислити абсолютну і відносну похибки, записати кінцевий результат
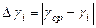 ,
, 
Результати вимірювань
D h 10= D h 20 =
| № |  , ,
|  , ,
| 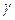 , ,
| 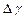 , ,
|
| СІ | ||||
| Ср. |
Завдання 2
Для експериментального визначення коефіцієнта Пуассона 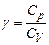 застосується установка ФПТ1-6 (рис.2), яка складається з: 1) блоку приладу БП-6 (поз.2), усередині якого знаходиться посудина з повітрям; 2) блоку манометра (поз.3); 3) стійки (поз.4). На лицьовій панелі блоку БП-6 розміщені пристрої керування, елементи світлової індикації, пневмотумблер для випускання повітря в атмосферу. Візуально блок приладу розділений на два модулі:
застосується установка ФПТ1-6 (рис.2), яка складається з: 1) блоку приладу БП-6 (поз.2), усередині якого знаходиться посудина з повітрям; 2) блоку манометра (поз.3); 3) стійки (поз.4). На лицьовій панелі блоку БП-6 розміщені пристрої керування, елементи світлової індикації, пневмотумблер для випускання повітря в атмосферу. Візуально блок приладу розділений на два модулі:
|
|
|
1) модуль живлення “ Мережа ” з тумблером вмикання живлення мікропроцесора та світлодіодом;
2) модуль “ Повітря ” з тумблером вмикання подачі повітря в колбу та світлодіодом.
Для підключення колби до пневмомережі над нею є два вивідних штуцери. Блок манометра призначений для вимірювання тиску в колбі. У верхній частині цього блоку розміщена пастка для води. Стійка є настільною конструкцією, на якій закріплені блоки БП-6 та блок манометра.
Хід роботи

1. Увімкнути установку тумблером “ Мережа ”.
2. Увімкнути подачу повітря у колбу тумблером “ Повітря ”.
3. За допомогою манометра контролювати тиск у колбі. Коли різниця рівнів води у манометрі досягне 150-250 мм вод. ст., припинити подачу повітря.
4. Зачекати 2-3хв, доки температура повітря у колбі зрівняється з температурою навколишнього повітря. У колбі при цьому встановлюється сталий тиск 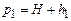 . Визначити різницю рівнів
. Визначити різницю рівнів  і одержане значення занести до таблиці результатів.
і одержане значення занести до таблиці результатів.
5. На короткий час з’єднати колбу з атмосферою, швидко повернувши за годинниковою стрілкою ручку клапана “ Атмосфера ” із одного крайнього положення до іншого.
6. Через 2-3хв, коли в колбі встановиться сталий тиск 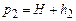 , визначити різницю рівнів
, визначити різницю рівнів  і одержане значення занести до таблиці результатів.
і одержане значення занести до таблиці результатів.
7. Повторити виміри за пн.2-6 не менше 5 разів для різних значень величин  .
.
8. Вимкнути установку тумблером “ Мережа ”.
9. Обчислити за робочою формулою (15) коефіцієнт Пуассона g.
10. Визначити середнє значення g.
11. Обчислити абсолютну зі відносну похибки, записати кінцевий результат

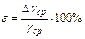
Результати вимірювань
D h 10= D h 20 =
| № |  , ,
|  , ,
|  , ,
| 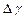 , ,
|
| СІ | ||||
| Ср. |
Контрольні запитання
|
|
|
1. Що розуміють під внутрішньою енергією тіла, кількістю теплоти? Сформулюйте перший закон термодинаміки та запишіть його математичний вираз.
2. Який процес називають ізотермічним, ізохорним, ізобарним, адіабатним? Запишіть вирази роботи розширення ідеального газу для цих процесів.
3. Запишіть перший закон термодинаміки для ізопроцесів та адіабатного процесу. Який термодинамічний зміст універсальної газової сталої?
4. Дайте визначення числа ступенів вільності молекул. Скільки ступенів вільності мають молекули з різною кількістю атомів? Запишіть вираз для внутрішньої енергії ідеального газу.
5. Що називають питомою та молярною теплоємностями і який зв’язок між ними? Що таке  і
і  ? Чому для газів
? Чому для газів  ?
?
6. Обчисліть  для повітря, вважаючи його двохатомним газом. Порівняйте теоретичне значення
для повітря, вважаючи його двохатомним газом. Порівняйте теоретичне значення  з одержаним вами експериментальними даними. Зробіть висновок.
з одержаним вами експериментальними даними. Зробіть висновок.
7. Виведіть робочу формулу.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 793; Нарушение авторских прав?; Мы поможем в написании вашей работы!