
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електронна будова атому Карбону
|
|
|
|
(Незбуджений стан):
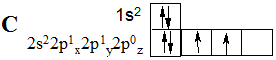
Енергію, що витрачається на збудження 2s -електрону до найбільш високого енергетичного 2р -підрівеня, з надлишком покриває виділення енергії за рахунок утворення чотирьох ковалентних зв’язків порівняно з енергією двох ковалентних зв’язків для незбудженого атому Карбону. Тому в переважній більшості сполуки Карбону є чотирьохвалентними.
Сполуки двохвалентного атому Карбону (С) є дуже реакційноздатними.
2.1. Поняття про гібридизацію атомів Карбону.
Зважаючи на електронну формулу атому Карбону в збудженому стані, Карбон має чотири валентні електрони, один з яких відрізняється за усіма параметрами від інших, а це означає, що зв’язок утворений s -електроном обов’язково повинен був би відрізнятися від інших зв’язків.
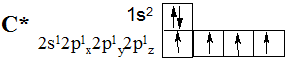
У разі гібридизації одної s -та трьох р -орбіталей утворюється чотири
sp3-гібридних орбіталей, що повністю ідентичні за енергією, формою, взаємним розташуванням у просторі. Ці орбіталі розташовані у просторі таким чином, що зорієнтовані від центру уявного тетраедру до його вершин. Ця гібридизація має назву тетрагональної, в ній кути між напрямками гібридних орбіталей складають близько 109°. Вона характерна для насичених сполук Карбону – алканів.
Для сполук, що містять ненасичені подвійні зв’язки, є характерною
sp2-гібридизація. В ній три гібридні орбіталі розташовані в одній площині під кутами 120°, а негібридизована р -орбіталь зорієнтована перпендикулярно цій площині. Ця гібридизація ще має назву тригональної або плоскої.
Для сполук з потрійними зв’язками характерна sp-гібридизація, в утворенні якої беруть участь s - i р -орбіталь, причому ще дві р -орбіталі лишаються негібридизованими. Негібридизовані р -орбіталі розташовані у двох взаємно-перпендикулярних площинах, а гібридні sp- орбіталі орієнтуються вздовж лінії перетину цих площин. Ця гібридизація має назву лінійна.
|
|
|
3. Типи хімічних зв’язків в органічних сполуках
Деяка частина органічних молекул має аніонну структуру, тобто містить іонні зв’язки. Найбільш розповсюдженим типом зв’язків в органічних сполуках є ковалентні зв’язки. Також дуже розповсюджені водневі зв’язки, що в багатьох випадках зумовлюють специфічні фізико-хімічні властивості органічних сполук.
3.1. Характеристики ковалентного зв’язку
Характеристикою зв’язку є його енергія (та, що виділяється при його утворенні).
Специфічні особливості зв’язку:
1) напрямленість у просторі;
2) валентні кути між напрямками зв’язків:
- для насичених ~ 109°;
- для алкенів ~ 120°;
- для алкінів ~ 180°.
3) довжина зв’язку:
- простий – 0,154 нм;
- кратний подвійний – 0,134 нм;
- кратний потрійний – 0,121 нм;
- ароматичний (кон’югований) – 0,141 нм.
4) полярність, поляризованість.
Полярність зв’язку зумовлюється різницею електронегативності атомів, що утворюють цей зв’язок. Чим більша різниця електронегативності атомів, тим більша полярність зв’язку.
Неполярні — Cl–Cl; N≡N.
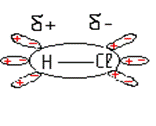 |
Полярні —
Поляризованість – зумовлена зміною полярності зв’язку під дією зовнішніх факторів. При цьому неполярний зв'язок може стати полярним, а полярний – може збільшити свою полярність до граничної межі, а саме до розриву ковалентного зв’язку.
3.2. Електронні впливи (електронні ефекти в молекулах)
Електронні ефекти в органічній хімії пояснюють за допомогою розширеної теорії Бутлерова, а саме положення про взаємний вплив атомів і груп атомів, що визначає фізико-хімічні властивості молекули в цілому. Виділяють два основних типи взаємного впливу атомів, що відповідають двом типам зміщення електронної густини у молекулах:
|
|
|
- індуктивні (індукційні) ефекти, що зумовлюють зміщення електронної густини по системі простих зв’язків (σ-зв’язків);
- мезомерні ефекти, що зумовлені зміщенням густини по системі кон’югованих π-зв’язків.
Якщо атом чи група атомів притягує до себе електронну густину, то ефект позначається знаком «–», а якщо відштовхує то — «+».
(+І) — позитивний індуктивний ефект;
(–І) — негативний індуктивний ефект;
(+М) — позитивний мезомерний ефект;
(–М) — негативний мезомерний ефект.
3.3. σ-(Сігма) та π-(пі)-зв’язки
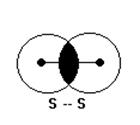 |
При утворенні σ-зв’язків електронні орбіталі перетинається таким чином, що уявна лінія, яка з’єднує центри ядер, пронизує зону згущення електронної густини, при цьому сили відштовхування між ядрами і сили притягування ядер до місця згущення електронної густини діють по одній прямій.
3.4. Типи утворення і види ковалентних зв’язків
Є два типи утворення ковалентних зв’язків:
1) «Класичний» (рівноподільний), полягає в тому, що кожен з атомів, які утворюють зв’язок, надає до спільної пари електронів по одному електрону.
2) Донорно-акцепторний тип полягає в тому, що один з атомів надає у спільне користування неподілену пару електронів (донор), а інший, який має вакантні орбіталі, тобто незаповнені оболонки, надає їх цій парі електронів і користується нею на рівних засадах з донором (акцептор).
Ковалентні зв’язки при розриві можуть утворювати частинки різного типу:
1) гомолітичний розрив (гомоліз):
А: В  А· + В· – радикали;
А· + В· – радикали;
2) гетеролітичний розрив (гетероліз):
 А:] В
А:] В  [A:]– + B+ – іони.
[A:]– + B+ – іони.
Гомоліз передує перебігу реакцій за радикальним механізмом, а гетероліз – іонним механізмом (аніонним чи катіонним). [1], c. 13-51; [2], с. 17-83.
4. Класифікація органічних сполук
Органічні сполуки:
- вуглеводні — сполуки, до складу яких входять атоми Карбону та Гідрогену. Вони відрізняються типом зв’язків між атомами Карбону (прості, подвійні, потрійні, ароматичні), а також типом карбонових ланцюгів (лінійні, розгалужені, циклічні);
- функціональні похідні вуглеводнів. Сполуки, які можна розглядати як продукти заміщення 1-го або більше атомів Гідрогену на функціональні групи.
Функціональна група – група атомів або окремий атом, що надає всій групі сполук спільних фізико-хімічних властивостей:
|
|
|
–OH — гідроксильна;
(–Cl, –Br, –I, –F) — галогени;
>C=O — кетонна (оксо-);
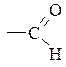 — альдегідна (карбонільна);
— альдегідна (карбонільна);
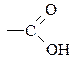 — карбоксильна;
— карбоксильна;
–NO2 — нітрогрупа;
–NН2 — аміногрупа;
- багатофункціональні похідні вуглеводнів та природні сполуки – сполуки складної будови, які містять одну або кілька функціональних груп або мають складну полімерну будову (вуглеводи, білки, пептиди).
Дещо окрему позицію займають гетероцикли, які не можна розглядати, як звичайні похідні вуглеводнів, оскільки в своїх переважно циклічних ароматичних ланцюгах, крім атомів Карбону, вони обов’язково містять інші атоми: О, N, S. Саме ця група сполук є однією з найбільш поширених у природних об’єктах (особливо рослинах) і має широкий спектр біологічної дії на організм. [2], с. 190-192.
5. Алкани СnH2n+2 (насичені, парафіни)
Молекула алканів складається з атомів Карбону і Гідрогену, сполучених простими зв’язками (σ-зв’язки).
5.1. Номенклатура і загальні принципи сучасної хімічної термінології
В основі номенклатури всіх органічних сполук за вимогами IUPAC лежать назви гомологічного ряду алканів.
Гомологічний ряд — це ряд сполук, що відрізняються між собою на одну або кілька метиленових груп СН2 (гомологічна різниця)
Алк ани Алк іли
1. Мет ан СН4 мет ил;
2. Етан С2Н6 ет ил;
3. Пропан С3Н8 проп іл
4. Бутан С4Н10 бут ил;
5. Пентан С5Н12; та ін..
6. Гексан С6Н14;
7. Гептан С7Н16;
8. Октан С8Н18;
9. Нонан С9Н20.
10. Декан С10Н22
-ан  -ил (-іл)
-ил (-іл)
5.2. Ізомерія алканів та їх одновалентних залишків (алкілів)
Ізомери — сполуки, що мають однаковий якісний та кількісний склад, але різний порядок зв’язку атомів у молекулі:

5.3. Поняття про первинні, вторинні, третинні атоми Карбону
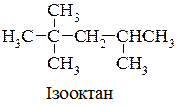
Первинний атом – це такий атом Карбону, який із чотирьох зв’язків використовує лише один на зв'язок із іншим атомом Карбону, вторинний – з двома іншими атомами Карбону і т.д..
Алкіли також поділяються на первинні, вторинні і третинні (четвертинних немає) залежно від того, біля якого атому Карбону знаходиться вільна валентність.
|
|
|
Алкіли існують в ізомерних формах, починаючи з пропілу:
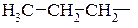 пропіл первинний,
пропіл первинний,  ізопропіл,
ізопропіл,
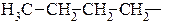 бутил первинний,
бутил первинний,
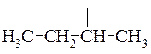 втор -бутил,
втор -бутил, 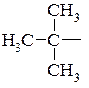 трет -бутил.
трет -бутил.
Приклад написання структурних формул структурних ізомерів молекули гептану.
1.  2.
2. 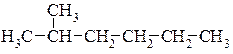
3. 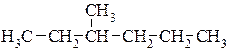 4.
4. 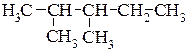
5. 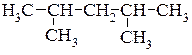 6.
6. 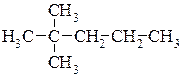
7. 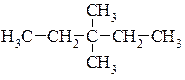 8.
8. 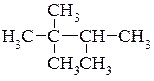
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 4932; Нарушение авторских прав?; Мы поможем в написании вашей работы!