
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические методы
|
|
|
|
К химическим методам очистки сточных вод относят нейтрализацию, коагулирование и флокулирование, окисление и восстановление. Химическая очистка проводится как доочистка вод перед биологической очисткой или после нее.
Нейтрализация. Сточные воды, содержащие кислоты или щелочи, перед сбросом в водоемы или перед технологическим использованием подвергаются нейтрализации. Практически нейтральными считаются воды, имеющие рН 6,5 – 8,5. Для нейтрализации кислых стоков используют щелочи, для нейтрализации щелочных – кислоты.
Нейтрализацию можно проводить различными путями: смешением кислых и щелочных сточных вод, добавлением реагентов, фильтрованием через нейтрализующие материалы. Для нейтрализации кислых вод используют щелочи (NaOH, KOH), соду (Na2CO3), аммиачную воду (NH4OH), карбонаты кальция и магния (CaCO3 и MgCO3), доломит (CaCO3*MgCO3), цемент. Однако наиболее дешевым реагентом является известковое молоко Ca(OH)2.
H+ +ОН ̄ → H2O
2 H+ +CaCO3 → Ca2+ + CO2 ↑ + H2O
Для нейтрализации щелочных сточных вод применяют отходящие газы, содержащие СО2, SО2, NО2, N2О3 и др. При этом происходит очистка дымовых газов от кислых компонентов.
SO2 + Са(ОН)2 = СаSО3↓ + Н2О
Метод реагентной (химической) обработки применяют для получения соединений, обладающих низкой степенью растворимости. Очистку сточных вод от ионов некоторых металлов (Cu+2, Ni+2, Fe+2 и др.) можно производить, используя щелочи. При рН = 8-9 обеспечивается наиболее полное осаждение труднорастворимых соединений меди, никеля и железа в результате реакции:
Ме2+ + 2ОН ̄ → Mе(ОН)2 ↓
Fе3+ + 3 Ca(OH)2→ Fe(OH)3↓ + 3Са2+
Cd2+ + S2-→ CdS↓
Рb2+ + CO32-→ PbCO3↓
2Fе3+ + 3 СО32-+3Н2О → 2 Fe(OH)3↓ + 3СО2↑
Коагуляция – это процесс укрупнения дисперсных частиц при их взаимодействии и объединения в агрегаты. В очистке сточных вод ее применяют для ускорения процесса осаждения тонкодисперсных примесей и эмульгированных веществ. Коагулянты в воде образуют хлопья гидратов окисей металлов, которые быстро оседают под действием силы тяжести и улавливают коллоидные и взвешенные частицы.
|
|
|
В качестве коагулянтов широко применяются соли алюминия и железа. При добавлении в воду они образуют положительно заряженные частицы. В ходе реакции гидролиза образуется нерастворимый гелеобразный гидроксид алюминия или трехвалентного железа:
A12(SО4)3 + 6Н2О → 2А1(ОН)3↓ + 3H2SО4
Флокуляция – это процесс агрегации взвешенных частиц при добавлении в сточную воду высокомолекулярных соединений, называемых флокулянтами. В отличие от коагуляции агрегатизация происходит не только в результате контакта, но и в результате взаимодействия флокулянта и извлекаемого вещества. Для очистки используют природные и синтетические флокулянты (полиакриламид, крахмал, целлюлозы).
Очистка окислением и восстановлением. Для очистки сточных вод используют следующие окислители: газообразный и сжиженный хлор, диоксид хлора, хлорную известь, гипохлориты кальция и натрия, перманганат калия, дихромат калия, перекись водорода, кислород воздуха, озон и др.
При окислении токсичные загрязнения переходят в менее токсичные с последующим удалением из воды. Очистка окислением связана с большим расходом реагентов, поэтому окисление используется тогда, когда загрязнители трудно извлечь другими способами.
Окисление хлором. Хлор и вещества, содержащие активный хлор являются наиболее распространенными окислителями. Их используют для очистки сточных вод от сероводорода, фенолов, цианидов и бактерий.
При обеззараживании вод от цианидов их окисляют до азота и диоксида углерода:
|
|
|
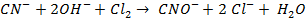
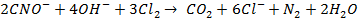
При хлорировании воды бактерии, находящиеся в воде, погибают в результате окисления веществ, входящих в состав протоплазмы клеток.
Окисление кислородом воздуха используется при очистке воды от железа, для окисления двухвалентного железа в трехвалентное и последующее отделение гидроксида железа(III):
4 Fe2+ + O2 + 2 H2O → 4 Fe3+ + 4 OH̅
Fe3+ + 3 H2O→Fe(OH)3 + 3 H+
Очистка восстановлением применяется в тех случаях, когда вода содержит легко восстанавливаемые вещества (соединения хрома, ртути, мышьяка). При этом их восстанавливают до более низкой степени окисления или металлов, а затем удаляют фильтрованием или флотацией.
Для восстановления Cr(VI) можно использовать металлическое железо или соли Fe(II). Наиболее хорошие результаты получают при рН = 2,5-3,0. Процесс восстановления протекает по реакции:
Cr2O72- + 6Fe2+ + 14 H+ = 2 Cr3+ + 6Fe3+ + 6 H2O
Для восстановления Cr(VI) можно также использовать SO2. Далее восстановленный хром осаждают известью:
2 Cr3+ + 3 Ca(OH)2 = 2 Cr(OH)3↓ + 3 Ca2+
Затем влажный осадок Cr(OH)3 прокаливают до образования Cr2O3, служащего источником получения хрома в промышленности:
2 Cr(OH)3↓  Cr2O3 + 3H2O
Cr2O3 + 3H2O
|
|
|
|
|
Дата добавления: 2015-05-07; Просмотров: 756; Нарушение авторских прав?; Мы поможем в написании вашей работы!